Cozaar 25mg, 50mg, 100mg Losartan Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Cozaar 50mg e come si usa?
Cozaar è un medicinale su prescrizione usato per trattare i sintomi della pressione alta (ipertensione), ridurre il rischio di ictus in alcune persone con malattie cardiache e dolore del nervo diabetico (neuropatia). Cozaar 100 mg può essere usato da solo o con altri farmaci.
Cozaar 25mg appartiene a una classe di farmaci chiamati antagonisti del recettore dell'angiotensina II (ARB).
Non è noto se Cozaar 25 mg sia sicuro ed efficace nei bambini di età inferiore ai 6 anni.
Quali sono i possibili effetti collaterali di Cozaar 100 mg?
Cozaar 100 mg può causare gravi effetti collaterali tra cui:
- stordimento,
- dolore o bruciore durante la minzione,
- nausea,
- debolezza,
- sensazione di formicolio,
- dolore al petto,
- battiti cardiaci irregolari,
- perdita di movimenti,
- minzione scarsa o assente,
- rapido aumento di peso e
- gonfiore alle mani, ai piedi o alle caviglie
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Cozaar includono:
- vertigini,
- mal di schiena, e
- sintomi del raffreddore (naso chiuso, starnuti, mal di gola)
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Cozaar. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
AVVERTIMENTO
TOSSICITÀ FETALE
Quando viene rilevata una gravidanza, interrompere COZAAR il prima possibile. I farmaci che agiscono direttamente sul sistema renina-angiotensina possono causare lesioni e morte al feto in via di sviluppo [vedi AVVERTENZE E PRECAUZIONI ].
DESCRIZIONE
COZAAR (losartan potassio) è un bloccante del recettore dell'angiotensina II che agisce sul sottotipo del recettore AT1. Il losartan potassio, una molecola non peptidica, è chimicamente descritta come sale monopotassico di 2-butil-4-cloro-1-[p-(o-1H-tetrazolo-5-ilfenil)benzil]imidazolo-5-metanolo.
La sua formula empirica è C22H22ClKN6O e la sua formula strutturale è:
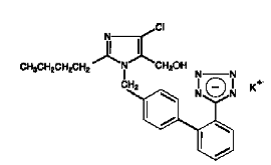
Losartan potassio è una polvere cristallina a flusso libero da bianca a biancastra con un peso molecolare di 461,01. È facilmente solubile in acqua, solubile in alcoli e leggermente solubile nei comuni solventi organici, come acetonitrile e metiletilchetone. L'ossidazione del gruppo 5-idrossimetile sull'anello imidazolico determina il metabolita attivo del losartan.
COZAAR 100 mg è disponibile sotto forma di compresse per somministrazione orale contenenti 25 mg, 50 mg o 100 mg di losartan potassico e i seguenti eccipienti: cellulosa microcristallina, lattosio idrato, amido pregelatinizzato, magnesio stearato, idrossipropilcellulosa, ipromellosa e biossido di titanio.
Le compresse di COZAAR 25 mg, 50 mg e 100 mg contengono potassio nelle seguenti quantità: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) e 8,48 mg (0,216 mEq), rispettivamente. COZAAR 25 mg, COZAAR 50 mg e COZAAR 100 mg possono contenere anche cera di carnauba.
INDICAZIONI
Ipertensione
COZAAR® è indicato per il trattamento dell'ipertensione negli adulti e nei pazienti pediatrici di età pari o superiore a 6 anni, per abbassare la pressione sanguigna. L'abbassamento della pressione sanguigna riduce il rischio di eventi cardiovascolari (CV) fatali e non fatali, principalmente ictus e infarto del miocardio. Questi benefici sono stati osservati in studi controllati di farmaci antipertensivi di un'ampia varietà di classi farmacologiche, incluso losartan.
Il controllo della pressione alta dovrebbe essere parte di una gestione completa del rischio cardiovascolare, inclusi, se del caso, il controllo dei lipidi, la gestione del diabete, la terapia antitrombotica, la cessazione del fumo, l'esercizio fisico e l'assunzione limitata di sodio. Molti pazienti richiedono più di 1 farmaco per raggiungere gli obiettivi di pressione sanguigna. Per consigli specifici su obiettivi e gestione, vedere le linee guida pubblicate, come quelle del Comitato nazionale congiunto per la prevenzione, il rilevamento, la valutazione e il trattamento dell'ipertensione (JNC) del National High Blood Pressure Education Program.
Numerosi farmaci antipertensivi, provenienti da una varietà di classi farmacologiche e con diversi meccanismi d'azione, hanno dimostrato in studi randomizzati controllati di ridurre la morbilità e la mortalità cardiovascolare e si può concludere che si tratta di una riduzione della pressione sanguigna e non di qualche altra proprietà farmacologica del farmaci, che è in gran parte responsabile di tali benefici. Il beneficio più ampio e consistente in termini di esito cardiovascolare è stato una riduzione del rischio di ictus, ma sono state osservate regolarmente anche riduzioni dell'infarto miocardico e della mortalità cardiovascolare.
Un'elevata pressione sistolica o diastolica provoca un aumento del rischio cardiovascolare e l'aumento assoluto del rischio per mmHg è maggiore a pressioni sanguigne più elevate, quindi anche riduzioni modeste dell'ipertensione grave possono fornire un beneficio sostanziale. La riduzione del rischio relativo dalla riduzione della pressione sanguigna è simile tra le popolazioni con rischio assoluto variabile, quindi il beneficio assoluto è maggiore nei pazienti che sono a rischio più elevato indipendentemente dalla loro ipertensione (ad esempio, pazienti con diabete o iperlipidemia) e ci si aspetta che tali pazienti ne traggano beneficio da un trattamento più aggressivo a un obiettivo di pressione sanguigna più bassa.
Alcuni farmaci antipertensivi hanno effetti minori sulla pressione sanguigna (come monoterapia) nei pazienti neri e molti farmaci antipertensivi hanno ulteriori indicazioni ed effetti approvati (p. es., su angina, insufficienza cardiaca o malattia renale diabetica). Queste considerazioni possono guidare la scelta della terapia.
COZAAR può essere somministrato con altri agenti antipertensivi.
Pazienti ipertesi con ipertrofia ventricolare sinistra
COZAAR 25 mg è indicato per ridurre il rischio di ictus nei pazienti con ipertensione e ipertrofia ventricolare sinistra, ma ci sono prove che questo beneficio non si applica ai pazienti neri [vedi Utilizzare in popolazioni specifiche e FARMACOLOGIA CLINICA ] .
Nefropatia nei pazienti diabetici di tipo 2
COZAAR è indicato per il trattamento della nefropatia diabetica con creatinina sierica elevata e proteinuria (rapporto albumina urinaria/creatinina ≥300 mg/g) in pazienti ricoverati con diabete di tipo 2 e una storia di ipertensione. In questa popolazione, COZAAR 50 mg riduce la velocità di progressione della nefropatia misurata dall'occorrenza del raddoppio della creatinina sierica o della malattia renale allo stadio terminale (necessità di dialisi o trapianto renale) [vedi Studi clinici ] .
DOSAGGIO E SOMMINISTRAZIONE
Ipertensione
Ipertensione adulta
La dose iniziale abituale di COZAAR 50 mg è di 50 mg una volta al giorno. Il dosaggio può essere aumentato fino a una dose massima di 100 mg una volta al giorno secondo necessità per controllare la pressione sanguigna [vedi Studi clinici ] . Una dose iniziale di 25 mg è raccomandata per i pazienti con possibile deplezione intravascolare (p. es., in terapia con diuretici).
Ipertensione Pediatrica
La dose iniziale raccomandata abitualmente è 0,7 mg per kg una volta al giorno (fino a 50 mg in totale) somministrata sotto forma di compressa o sospensione [vedere Preparazione della sospensione (per 200 ml di una sospensione da 2,5 mg/ml) ] .Il dosaggio deve essere regolato in base alla risposta pressoria. Dosi superiori a 1,4 mg per kg (o superiori a 100 mg) al giorno non sono state studiate nei pazienti pediatrici [vedere FARMACOLOGIA CLINICA , Studi clinici e AVVERTENZE E PRECAUZIONI ] .
COZAAR non è raccomandato nei pazienti pediatrici di età inferiore ai 6 anni o nei pazienti pediatrici con una velocità di filtrazione glomerulare stimata inferiore a 30 ml/min/1,73 m2 [vedere Utilizzare in popolazioni specifiche , FARMACOLOGIA CLINICA e Studi clinici ] .
Pazienti ipertesi con ipertrofia ventricolare sinistra
La dose iniziale abituale è 50 mg di COZAAR una volta al giorno. Si deve aggiungere idroclorotiazide 12,5 mg al giorno e/o la dose di COZAAR deve essere aumentata a 100 mg una volta al giorno seguita da un aumento dell'idroclorotiazide a 25 mg una volta al giorno in base alla risposta pressoria [vedere Studi clinici ] .
Nefropatia nei pazienti diabetici di tipo 2
La dose iniziale abituale è di 50 mg una volta al giorno. La dose deve essere aumentata a 100 mg una volta al giorno in base alla risposta pressoria [vedere Studi clinici ] .
Modifiche del dosaggio nei pazienti con insufficienza epatica
Nei pazienti con insufficienza epatica da lieve a moderata, la dose iniziale raccomandata di COZAAR è di 25 mg una volta al giorno. COZAAR non è stato studiato in pazienti con grave insufficienza epatica [vedi Utilizzare in popolazioni specifiche e FARMACOLOGIA CLINICA ] .
Preparazione della sospensione (per 200 ml di una sospensione da 2,5 mg/ml)
Aggiungere 10 ml di acqua purificata USP a un flacone da 8 once (240 ml) di polietilene tereftalato (PET) ambrato contenente dieci compresse di COZAAR da 50 mg. Agitare immediatamente per almeno 2 minuti. Lasciare riposare il concentrato per 1 ora e poi agitare per 1 minuto per disperdere il contenuto della compressa. Preparare separatamente una miscela volumetrica 50/50 di Ora-Plus™ e Ora-Sweet SF™. Aggiungere 190 ml della miscela 50/50 Ora-Plus™/Ora-Sweet SF™ alla compressa e alla sospensione d'acqua nella bottiglia in PET e agitare per 1 minuto per disperdere gli ingredienti. La sospensione deve essere refrigerata a 2-8°C (36-46°F) e può essere conservata per un massimo di 4 settimane. Agitare la sospensione prima di ogni utilizzo e rimettere prontamente in frigorifero.
COME FORNITO
Forme di dosaggio e punti di forza
- COZAAR 100 mg, 25 mg, sono compresse bianche, ovali, rivestite con film con il codice 951 su un lato.
- COZAAR, 50 mg, sono compresse bianche, ovali, rivestite con film con codice 952 su un lato e linea di frattura sull'altro.
- COZAAR 25 mg, 100 mg, sono compresse rivestite con film bianche, a forma di lacrima, con il codice 960 su un lato.
Stoccaggio e manipolazione
COZAAR è una compressa bianca rivestita con film fornita come segue:
Conservare a 25°C (77°F); escursioni consentite a 15-30°C (59-86°F) [vedi Temperatura ambiente controllata USP]. Tenere il contenitore ben chiuso. Proteggi dalla luce.
Prodotto per: Organon LLC, una consociata di Organon & Co., Jersey City, NJ 07302, USA. Revisionato: ottobre 2021.
EFFETTI COLLATERALI
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni molto variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
Ipertensione
COZAAR è stata valutata per la sicurezza in più di 3300 pazienti adulti trattati per ipertensione essenziale e 4058 pazienti/soggetti in totale. Oltre 1200 pazienti sono stati trattati per oltre 6 mesi e più di 800 per oltre un anno.
Il trattamento con COZAAR 25 mg è stato ben tollerato con un'incidenza complessiva di eventi avversi simile a quella del placebo. Negli studi clinici controllati, l'interruzione della terapia per eventi avversi si è verificata nel 2,3% dei pazienti trattati con COZAAR 25 mg e nel 3,7% dei pazienti trattati con placebo. In 4 studi clinici che hanno coinvolto oltre 1000 pazienti a varie dosi (10-150 mg) di losartan potassico e oltre 300 pazienti trattati con placebo, gli eventi avversi che si sono verificati in ≥2% dei pazienti trattati con COZAAR 25 mg e più comunemente rispetto al placebo sono stati: capogiri (3 % contro 2%), infezione delle vie respiratorie superiori (8% contro 7%), congestione nasale (2% contro 1%) e mal di schiena (2% contro 1%).
Sono state segnalate le seguenti reazioni avverse meno comuni:
Patologie del sistema emolinfopoietico: Anemia.
Disturbi psichiatrici: Depressione.
Disturbi del sistema nervoso: Sonnolenza, cefalea, disturbi del sonno, parestesie, emicrania.
Patologie dell'orecchio e del labirinto: Vertigini, acufeni.
Patologie cardiache: Palpitazioni, sincope, fibrillazione atriale, CVA.
Patologie respiratorie, toraciche e mediastiniche: Dispnea.
Disordini gastrointestinali: Dolore addominale, costipazione, nausea, vomito.
Patologie della cute e del tessuto sottocutaneo: Orticaria, prurito, eruzione cutanea, fotosensibilità.
Patologie del sistema muscoloscheletrico e del tessuto connettivo: Mialgia, artralgia.
Disturbi dell'apparato riproduttivo e della mammella: Impotenza.
Patologie sistemiche e condizioni relative alla sede di somministrazione: Edema.
Tosse
La tosse secca persistente (con un'incidenza di pochi punti percentuali) è stata associata all'uso di ACE-inibitori e in pratica può essere causa di interruzione della terapia con ACE-inibitori. Sono stati condotti due studi prospettici, a gruppi paralleli, in doppio cieco, randomizzati e controllati per valutare gli effetti del losartan sull'incidenza di pazienti con tosse inipertensiva che avevano manifestato tosse durante la terapia con ACE-inibitori. I pazienti che presentavano tosse tipica da ACE-inibitore quando trattati con lisinopril, la cui tosse è scomparsa con il placebo, sono stati randomizzati a losartan 50 mg, lisinopril 20 mg o placebo (uno studio, n=97) o 25 mg di idroclorotiazide (n=135). Il periodo di trattamento in doppio cieco è durato fino a 8 settimane. L'incidenza della tosse è mostrata nella Tabella 1 di seguito.
Questi studi dimostrano che l'incidenza della tosse associata alla terapia con losartan, in una popolazione che presentava tutta tosse associata alla terapia con ACE-inibitori, è simile a quella associata alla terapia con idroclorotiazide o placebo.
Nell'esperienza post-marketing sono stati segnalati casi di tosse, comprese ricadute positive, con l'uso di losartan.
Pazienti ipertesi con ipertrofia ventricolare sinistra
Nello studio Losartan Intervention for Endpoint (LIFE), le reazioni avverse con COZAAR 100 mg sono state simili a quelle riportate in precedenza per i pazienti con ipertensione.
Nefropatia nei pazienti diabetici di tipo 2
Nello studio Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan (RENAAL) che ha coinvolto 1513 pazienti trattati con COZAAR 100 mg o placebo, l'incidenza complessiva degli eventi avversi segnalati è stata simile per i due gruppi. Le interruzioni di COZAAR a causa di effetti collaterali sono state simili al placebo (19% per COZAAR 100 mg, 24% per placebo). Gli eventi avversi, indipendentemente dalla relazione farmacologica, riportati con un'incidenza ≥4% dei pazienti trattati con COZAAR 50 mg e che si sono verificati con una differenza ≥2% nel gruppo losartan rispetto al placebo in un contesto di terapia antipertensiva convenzionale, sono stati astenia/stanchezza, dolore toracico , ipotensione, ipotensione ortostatica, diarrea, anemia, iperkaliemia, ipoglicemia, mal di schiena, debolezza muscolare e infezioni del tratto urinario.
Esperienza di post marketing
Le seguenti reazioni avverse aggiuntive sono state riportate nell'esperienza post-marketing con COZAAR. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne la frequenza in modo affidabile o stabilire una relazione causale con l'esposizione al farmaco:
Digestivo: Epatite.
Disturbi generali e condizioni del sito di amministrazione: Malessere.
Ematologico: Trombocitopenia.
Ipersensibilità: Raramente nei pazienti trattati con losartan è stato riportato angioedema, compreso gonfiore della laringe e della glottide, che causa ostruzione delle vie aeree e/o gonfiore del viso, delle labbra, della faringe e/o della lingua; alcuni di questi pazienti hanno precedentemente manifestato angioedema con altri farmaci, inclusi gli ACE-inibitori. È stata segnalata vasculite, inclusa la porpora di Henoch-Schönlein. Sono state riportate reazioni anafilattiche.
Metabolici e Nutrizione: Iponatremia.
Muscoloscheletrico: Rabdomiolisi.
Disturbi del sistema nervoso: Disgeusia.
Pelle: Eritrodermia.
INTERAZIONI DI DROGA
Agenti che aumentano il potassio sierico
La somministrazione concomitante di losartan con altri farmaci che aumentano i livelli sierici di potassio può causare iperkaliemia. Monitorare il potassio sierico in questi pazienti.
Litio
Sono stati riportati aumenti delle concentrazioni sieriche di litio e della tossicità del litio durante la somministrazione concomitante di litio con antagonisti del recettore dell'angiotensina II. Monitorare i livelli sierici di litio durante l'uso concomitante.
Farmaci antinfiammatori non steroidei (FANS) compresi gli inibitori selettivi della ciclossigenasi-2 (inibitori della COX-2)
Nei pazienti anziani, ipovolemia (compresi quelli in terapia con diuretici) o con funzionalità renale compromessa, la somministrazione concomitante di FANS, inclusi gli inibitori selettivi della COX-2, con antagonisti del recettore dell'angiotensina II (incluso losartan) può causare un deterioramento della funzione renale, compresa la possibile insufficienza renale acuta. Questi effetti sono generalmente reversibili. Monitorare periodicamente la funzione renale nei pazienti che ricevono losartan e terapia con FANS.
L'effetto antipertensivo degli antagonisti del recettore dell'angiotensina II, incluso losartan, può essere attenuato dai FANS, inclusi gli inibitori selettivi della COX-2.
Doppio blocco del sistema renina-angiotensina (RAS)
Il doppio blocco del RAS con bloccanti del recettore dell'angiotensina, ACE-inibitori o aliskiren è associato a un aumento del rischio di ipotensione, sincope, iperkaliemia e alterazioni della funzione renale (inclusa insufficienza renale acuta) rispetto alla monoterapia.
Lo studio Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) ha arruolato 1448 pazienti con diabete di tipo 2, rapporto urinario-albumina-creatinina elevato e velocità di filtrazione glomerulare stimata ridotta (GFR da 30 a 89,9 ml/min), li ha randomizzati a lisinopril o placebo su uno sfondo di terapia con losartan e li ha seguiti per una mediana di 2,2 anni. I pazienti che hanno ricevuto la combinazione di losartan e lisinopril non hanno ottenuto alcun beneficio aggiuntivo rispetto alla monoterapia per l'endpoint combinato di diminuzione della GFR, malattia renale allo stadio terminale o morte, ma hanno manifestato una maggiore incidenza di iperkaliemia e danno renale acuto rispetto al gruppo in monoterapia.
Nella maggior parte dei pazienti nessun beneficio è stato associato all'uso concomitante di due inibitori del RAS. In generale, evitare l'uso combinato di inibitori RAS. Monitorare attentamente la pressione sanguigna, la funzionalità renale e gli elettroliti nei pazienti trattati con COZAAR 100 mg e altri agenti che influiscono sul RAS.
Non co-somministrare aliskiren con COZAAR 100 mg in pazienti con diabete. Evitare l'uso di aliskiren con COZAAR in pazienti con insufficienza renale (GFR
AVVERTENZE
Incluso come parte del "PRECAUZIONI" Sezione
PRECAUZIONI
Tossicità fetale
COZAAR può causare danni al feto se somministrato a una donna incinta. L'uso di farmaci che agiscono sul sistema renina-angiotensina durante il secondo e il terzo trimestre di gravidanza riduce la funzione renale fetale e aumenta la morbilità e la morte fetale e neonatale. L'oligoidramnios risultante può essere associato a ipoplasia polmonare fetale e deformazioni scheletriche. I potenziali effetti avversi neonatali comprendono ipoplasia cranica, anuria, ipotensione, insufficienza renale e morte. Quando viene rilevata una gravidanza, interrompere COZAAR 100 mg il prima possibile [vedi Utilizzare in popolazioni specifiche ] .
Ipotensione nei pazienti con volume o impoverito di sale
Nei pazienti con un sistema renina-angiotensina attivato, come i pazienti con volume o deplezione di sale (p. es., quelli trattati con dosi elevate di diuretici), dopo l'inizio del trattamento con COZAAR può verificarsi sintomaticipotensione. Corretto volume o deplezione salina prima della somministrazione di COZAAR [vedi DOSAGGIO E SOMMINISTRAZIONE ] .
Deterioramento della funzione renale
Alterazioni della funzione renale, inclusa l'insufficienza renale acuta, possono essere causate da farmaci che inibiscono il sistema renina-angiotensina e da diuretici. I pazienti la cui funzione renale può dipendere in parte dall'attività del sistema renina-angiotensina (p. es., pazienti con stenosi dell'arteria renale, malattia renale cronica, grave insufficienza cardiaca congestizia o deplezione di volume) possono essere particolarmente a rischio di sviluppare insufficienza renale acuta con COZAAR. Monitorare periodicamente la funzionalità renale in questi pazienti. Considerare la sospensione o l'interruzione della terapia nei pazienti che sviluppano una diminuzione clinicamente significativa della funzione renale su COZAAR [vedi INTERAZIONI DI DROGA e Utilizzare in popolazioni specifiche ] .
Iperkaliemia
Monitorare periodicamente il potassio sierico e trattarlo in modo appropriato. Potrebbe essere necessaria una riduzione del dosaggio o l'interruzione di COZAAR 25 mg [vedi REAZIONI AVVERSE ] .
L'uso concomitante di altri farmaci che possono aumentare il potassio sierico può portare a iperkaliemia [vedi INTERAZIONI DI DROGA ] .
Informazioni di consulenza per il paziente
Consigliare al paziente di leggere l'etichettatura del paziente approvata dalla FDA (Informazioni sul paziente).
Gravidanza
Informare le pazienti in età fertile sulle conseguenze dell'esposizione a COZAAR 100 mg durante la gravidanza. Discutere le opzioni di trattamento con le donne che stanno pianificando una gravidanza. Dire alle pazienti di riferire le gravidanze ai loro medici il prima possibile [vedi AVVERTENZE E PRECAUZIONI e Utilizzare in popolazioni specifiche ] .
Integratori di potassio
Consigliare ai pazienti che assumono COZAAR di non utilizzare integratori di potassio o sostituti del sale contenenti potassio senza consultare il proprio medico [vedi INTERAZIONI DI DROGA ] .
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Il losartan potassico non è risultato cancerogeno quando somministrato ai dosaggi massimamente tollerati a ratti e topi rispettivamente per 105 e 92 settimane. Le femmine di ratto a cui è stata somministrata la dose più alta (270 mg/kg/die) hanno avuto un'incidenza leggermente maggiore di adenoma acinoso pancreatico. I dosaggi massimamente tollerati (270 mg/kg/die nei ratti, 200 mg/kg/die nei topi) hanno fornito esposizioni sistemiche per losartan e il suo metabolita farmacologicamente attivo che erano circa 160 e 90 volte (ratti) e 30 e 15 volte (topi) l'esposizione di un essere umano di 50 kg a cui sono stati somministrati 100 mg al giorno.
Il losartan potassio è risultato negativo nei test di mutagenesi microbica e di mutagenesi delle cellule di mammifero V-79 e nell'eluizione alcalina in vitro e nei test di aberrazione cromosomica in vitro e in vivo. Inoltre, il metabolita attivo non ha mostrato evidenza di genotossicità nei test di mutagenesi microbica, eluizione alcalina in vitro e aberrazione cromosomica in vitro.
La fertilità e le prestazioni riproduttive non sono state alterate negli studi con ratti maschi trattati con dosi orali di losartan potassico fino a circa 150 mg/kg/die. La somministrazione di livelli di dosaggio tossici nelle donne (300/200 mg/kg/die) è stata associata a una diminuzione significativa (p
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
COZAAR può causare danni al feto se somministrato a una donna incinta. L'uso di farmaci che agiscono sul sistema renina-angiotensina durante il secondo e il terzo trimestre di gravidanza riduce la funzione renale fetale e aumenta la morbilità e la morte fetale e neonatale. La maggior parte degli studi epidemiologici che esaminano le anomalie fetali dopo l'esposizione all'uso di antipertensivi nel primo trimestre non hanno distinto i farmaci che agiscono sul sistema renina-angiotensina da altri agenti antipertensivi. Quando viene rilevata una gravidanza, interrompere COZAAR il prima possibile (vedi Considerazioni cliniche ).
Il rischio di fondo stimato di gravi difetti alla nascita e aborto spontaneo per la popolazione indicata non è noto. Tutte le gravidanze hanno un rischio di fondo di difetti alla nascita, perdita o altri esiti avversi. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo nelle gravidanze clinicamente riconosciute è compreso rispettivamente tra il 2% e il 4% e tra il 15% e il 20%.
Considerazioni cliniche
Rischio materno e/o embrionale/fetale associato alla malattia
L'ipertensione in gravidanza aumenta il rischio materno di pre-eclampsia, diabete gestazionale, parto prematuro e complicazioni del parto (p. es., necessità di taglio cesareo, emorragia post-partum). L'ipertensione aumenta il rischio fetale di restrizione della crescita intrauterina e morte intrauterina. Le donne in gravidanza con ipertensione dovrebbero essere attentamente monitorate e gestite di conseguenza.
Reazioni avverse fetali/neonatali
L'oligoidramnios nelle donne in gravidanza che usano farmaci che agiscono sul sistema renina-angiotensina nel secondo e terzo trimestre di gravidanza può causare quanto segue:ridotta funzionalità renale fetale che porta ad anuria e insufficienza renale, ipoplasia polmonare fetale, deformazioni scheletriche, inclusa ipoplasia del cranio, ipotensione , e la morte. Nel caso insolito che non vi sia un'alternativa appropriata alla terapia con farmaci che agiscono sul sistema renina-angiotensina per un particolare paziente, informare la madre del potenziale rischio per il feto.
Nelle pazienti che assumono COZAAR durante la gravidanza, eseguire esami ecografici seriali per valutare l'ambiente intra-amniotico. I test fetali possono essere appropriati, in base alla settimana di gestazione. Se si osserva oligoidramnios, interrompere COZAAR 50 mg, a meno che non sia considerato salvavita per la madre. I pazienti e i medici devono essere consapevoli, tuttavia, che l'oligoidramnios potrebbe non comparire fino a dopo che il feto non ha subito una lesione irreversibile.
Osservare attentamente i neonati con storie di esposizione in utero a COZAAR per ipotensione, oliguria e iperkaliemia. Nei neonati con una storia di esposizione in utero a COZAAR 100 mg, se si verifica oliguria o ipotensione, sostenere la pressione sanguigna e la perfusione renale. Possono essere necessarie trasfusioni di scambio o dialisi come mezzo per invertire l'ipotensione e sostituire la funzione renale.
Dati
Dati sugli animali
Losartan potassico è stato somministrato per via orale ai ratti durante il periodo dalla tarda gestazione all'allattamento (dal giorno 15 alla lattazione fino al giorno 20 dell'allattamento) a dosi di 10, 25 e 100 mg/kg/giorno. È stato dimostrato che il losartan potassico produce effetti avversi nei feti di ratto e nei neonati, tra cui diminuzione del peso corporeo, ritardo dello sviluppo fisico e comportamentale, mortalità e tossicità renale. Con l'eccezione dell'aumento di peso neonatale (che è stato influenzato a dosi fino a 10 mg/kg/die), le dosi associate a questi effetti hanno superato i 25 mg/kg/die (circa tre volte la dose massima raccomandata nell'uomo di 100 mg per mg /m base). Questi risultati sono attribuiti all'esposizione al farmaco nella tarda gestazione e durante l'allattamento. È stato dimostrato che livelli significativi di losartan e del suo metabolita attivo sono presenti nel plasma fetale di ratto durante la tarda gestazione e nel latte di ratto.
Allattamento
Riepilogo dei rischi
Non è noto se losartan sia escreto nel latte materno, ma è stato dimostrato che livelli significativi di losartan e del suo metabolita attivo sono presenti nel latte di ratto. A causa dei potenziali effetti avversi sul lattante, si dovrebbe decidere se interrompere l'allattamento o interrompere il farmaco, tenendo conto dell'importanza del farmaco per la madre.
Uso pediatrico
Gli effetti antipertensivi di COZAAR sono stati accertati in pazienti pediatrici ipertesi di età compresa tra 6 e 16 anni. La sicurezza e l'efficacia non sono state stabilite in pazienti pediatrici di età inferiore ai 6 anni o in pazienti pediatrici con velocità di filtrazione glomerulare DOSAGGIO E SOMMINISTRAZIONE , FARMACOLOGIA CLINICA e Studi clinici ] .
Uso geriatrico
Del numero totale di pazienti trattati con COZAAR 25 mg in studi clinici controllati per l'ipertensione, 391 pazienti (19%) avevano 65 anni e più, mentre 37 pazienti (2%) avevano 75 anni e più. In uno studio clinico controllato per la protezione renale in pazienti diabetici di tipo 2 con proteinuria, 248 pazienti (33%) avevano 65 anni e più. In uno studio clinico controllato per la riduzione del rischio combinato di morte cardiovascolare, ictus e infarto miocardico in pazienti ipertesi con ipertrofia ventricolare sinistra, 2857 pazienti (62%) avevano 65 anni e più, mentre 808 pazienti (18%) avevano 75 anni e più . Non sono state osservate differenze complessive in termini di efficacia o sicurezza tra questi pazienti e i pazienti più giovani, ma non può essere esclusa una maggiore sensibilità di alcuni individui più anziani.
Gara
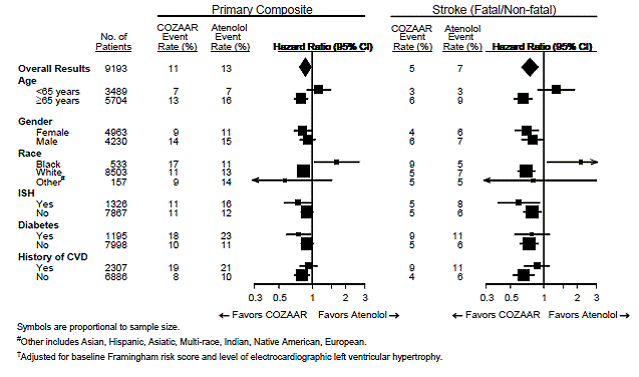
Nello studio LIFE, i pazienti neri con ipertensione e ipertrofia ventricolare sinistra trattati con atenololo erano a minor rischio di manifestare l'endpoint composito primario rispetto ai pazienti neri trattati con COZAAR (entrambi trattati con idroclorotiazide nella maggior parte dei pazienti). L'endpoint primario era il primo verificarsi di ictus, infarto del miocardio o morte cardiovascolare, analizzato utilizzando un approccio intention-to-treat (ITT). Nel sottogruppo dei pazienti neri (n=533, 6% dei pazienti dello studio LIFE), c'erano 29 endpoint primari tra 263 pazienti in trattamento con atenololo (11%, 26 per 1000 anni-paziente) e 46 endpoint primari tra 270 pazienti (17% , 42 per 1000 anni-paziente) su COZAAR. Questo risultato non può essere spiegato sulla base di differenze nelle popolazioni diverse dalla razza o su eventuali squilibri tra i gruppi di trattamento. Inoltre, le riduzioni della pressione sanguigna in entrambi i gruppi di trattamento erano coerenti tra i pazienti neri e non neri. Data la difficoltà nell'interpretare le differenze di sottoinsiemi in ampi studi, non si può sapere se la differenza osservata sia il risultato del caso. Tuttavia, lo studio LIFE non fornisce alcuna prova che i benefici di COZAAR 100 mg sulla riduzione del rischio di eventi cardiovascolari nei pazienti ipertesi con ipertrofia ventricolare sinistra si applichino ai pazienti neri [vedi Studi clinici ] .
Insufficienza renale
pazienti con insufficienza renale hanno concentrazioni plasmatiche elevate di losartan e del suo metabolita attivo rispetto ai soggetti con funzionalità renale normale. Non è necessario alcun aggiustamento della dose nei pazienti con insufficienza renale, a meno che un paziente con insufficienza renale non sia anche volume depleto [vedi DOSAGGIO E SOMMINISTRAZIONE , AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ] .
Insufficienza epatica
La dose iniziale raccomandata di COZAAR è di 25 mg nei pazienti con insufficienza epatica da lieve a moderata. Dopo somministrazione orale in pazienti con insufficienza epatica da lieve a moderata, le concentrazioni plasmatiche di losartan e del suo metabolita attivo erano, rispettivamente, 5 volte e 1,7 volte quelle osservate in volontari sani.COZAAR non è stato studiato in pazienti con insufficienza epatica grave [vedere DOSAGGIO E SOMMINISTRAZIONE e FARMACOLOGIA CLINICA ] .
OVERDOSE
Una mortalità significativa è stata osservata nei topi e nei ratti dopo somministrazione orale di 1000 mg/kg e 2000 mg/kg, rispettivamente, circa 44 e 170 volte la dose massima raccomandata nell'uomo su base mg/m2.
Sono disponibili dati limitati sul sovradosaggio nell'uomo. La manifestazione più probabile di sovradosaggio sarebbe ipotensione e tachicardia; la bradicardia potrebbe verificarsi da stimolazione parasimpatica (vagale). Se dovesse verificarsi ipotensione sintomatica, deve essere istituito un trattamento di supporto.
Né il losartan né il suo metabolita attivo possono essere rimossi mediante emodialisi.
CONTROINDICAZIONI
COZAAR 50mg è controindicato:
- Nei pazienti che sono ipersensibili a qualsiasi componente di questo prodotto.
- Per la co-somministrazione con aliskiren in pazienti con diabete.
FARMACOLOGIA CLINICA
Meccanismo di azione
L'angiotensina II [formata dall'angiotensina I in una reazione catalizzata dall'enzima di conversione dell'angiotensina (ACE, chinasi II)] è un potente vasocostrittore, l'ormone vasoattivo primario del sistema renina-angiotensina e un componente importante nella fisiopatologia dell'ipertensione. Stimola anche la secrezione di aldosterone da parte della corteccia surrenale. Losartan e il suo principale metabolita attivo bloccano gli effetti vasocostrittori e secernenti aldosterone dell'angiotensina II bloccando selettivamente il legame dell'angiotensina II al recettore AT1 presente in molti tessuti (p. es., muscolatura liscia vascolare, ghiandola surrenale). Esiste anche un recettore AT1 che si trova in molti tessuti, ma non è noto che sia associato all'omeostasi cardiovascolare. Né il losartan né il suo principale metabolita attivo esibiscono alcuna attività agonista parziale sul recettore AT1 ed entrambi hanno un'affinità molto maggiore (circa 1000 volte) per il recettore AT1 che per il recettore AT1. Studi di legame in vitro indicano che losartan è un inibitore competitivo e reversibile del recettore AT1. Il metabolita attivo è da 10 a 40 volte più potente in peso del losartan e sembra essere un inibitore reversibile e non competitivo del recettore AT1.
Né il losartan né il suo metabolita attivo inibiscono l'ACE (kininasi II, l'enzima che converte l'angiotensina I in angiotensina II e degrada la bradichinina), né si legano o bloccano altri recettori ormonali o canali ionici noti per essere importanti nella regolazione cardiovascolare.
Farmacodinamica
Losartan inibisce l'effetto pressorio delle infusioni di angiotensina II (così come angiotensina I). Una dose di 100 mg inibisce l'effetto pressorio di circa l'85% al picco con un'inibizione del 25-40% che persiste per 24 ore. La rimozione del feedback negativo dell'angiotensina II provoca il raddoppio o il triplo dell'attività della renina plasmatica e il conseguente aumento della concentrazione plasmatica dell'angiotensina II nei pazienti ipertesi. Losartan non influenza la risposta alla bradichinina, mentre gli ACE-inibitori aumentano la risposta alla bradichinina. Le concentrazioni plasmatiche di aldosterone diminuiscono dopo la somministrazione di losartan. Nonostante l'effetto del losartan sulla secrezione di aldosterone, è stato osservato uno scarso effetto sul potassio sierico.
L'effetto del losartan è sostanzialmente presente entro una settimana, ma in alcuni studi l'effetto massimo si è verificato in 3-6 settimane. Negli studi di follow-up a lungo termine (senza controllo con placebo) l'effetto del losartan sembrava essere mantenuto fino a un anno. Non vi è alcun effetto di rimbalzo apparente dopo la sospensione improvvisa di losartan. In studi controllati non vi è stato essenzialmente alcun cambiamento nella frequenza cardiaca media nei pazienti trattati con losartan.
Farmacocinetica
Assorbimento
Dopo somministrazione orale, losartan è ben assorbito e subisce un sostanziale metabolismo di primo passaggio. La biodisponibilità sistemica del losartan è di circa il 33%. Le concentrazioni medie di picco di losartan e del suo metabolita attivo vengono raggiunte rispettivamente in 1 ora e in 3-4 ore. Sebbene le concentrazioni plasmatiche massime di losartan e del suo metabolita attivo siano approssimativamente uguali, l'AUC (area sotto la curva) del metabolita è circa 4 volte maggiore di quella di losartan. Un pasto rallenta l'assorbimento di losartan e ne diminuisce la Cmax, ma ha solo effetti minori sull'AUC del losartan o sull'AUC del metabolita (riduzione del ~10%). La farmacocinetica di losartan e del suo metabolita attivo è lineare con dosi orali di losartan fino a 200 mg e non cambia nel tempo.
Distribuzione
Il volume di distribuzione del losartan e del metabolita attivo è rispettivamente di circa 34 litri e 12 litri. Sia losartan che il suo metabolita attivo sono fortemente legati alle proteine plasmatiche, principalmente all'albumina, con frazioni plasmatiche libere rispettivamente dell'1,3% e dello 0,2%. Il legame con le proteine plasmatiche è costante nell'intervallo di concentrazione raggiunto con le dosi raccomandate. Gli studi sui ratti indicano che il losartan attraversa male la barriera ematoencefalica, se non del tutto.
Metabolismo
Losartan è un agente attivo per via orale che subisce un sostanziale metabolismo di primo passaggio da parte degli enzimi del citocromo P450. Viene convertito, in parte, in un metabolita attivo dell'acido carbossilico che è responsabile della maggior parte dell'antagonismo del recettore dell'angiotensina II che segue il trattamento con losartan. Circa il 14% di una dose somministrata per via orale di losartan viene convertito nel metabolita attivo. Oltre al metabolita attivo dell'acido carbossilico, si formano diversi metaboliti inattivi. Studi in vitro indicano che i citocromi P450 2C9 e 3A4 sono coinvolti nella biotrasformazione del losartan nei suoi metaboliti.
Eliminazione
La clearance plasmatica totale di losartan e del metabolita attivo è rispettivamente di circa 600 ml/min e 50 ml/min, con una clearance renale rispettivamente di circa 75 ml/min e 25 ml/min. L'emivita terminale del losartan è di circa 2 ore e quella del metabolita è di circa 6-9 ore. Dopo dosi singole di losartan somministrate per via orale, circa il 4% della dose viene escreto immodificato nelle urine e circa il 6% viene escreto nelle urine come metabolita attivo. L'escrezione biliare contribuisce all'eliminazione del losartan e dei suoi metaboliti. Dopo losartan orale marcato con 14C, circa il 35% della radioattività viene ritrovata nelle urine e circa il 60% nelle feci. Dopo una dose endovenosa di losartan marcato con 14C, circa il 45% della radioattività viene ritrovata nelle urine e il 50% nelle feci. Né il losartan né il suo metabolita accumulano nel plasma dopo somministrazioni ripetute una volta al giorno.
Popolazioni specifiche
pediatrico
parametri farmacocinetici dopo dosi multiple di losartan (dose media 0,7 mg/kg, intervallo da 0,36 a 0,97 mg/kg) in compresse a 25 pazienti ipertesi di età compresa tra 6 e 16 anni sono riportati nella Tabella 4 di seguito. La farmacocinetica del losartan e del suo metabolita attivo è stata generalmente simile nei gruppi di età studiati e simile ai dati storici di farmacocinetica negli adulti. I principali parametri farmacocinetici negli adulti e nei bambini sono riportati nella tabella seguente.
La biodisponibilità della formulazione in sospensione è stata confrontata con losartan compresse in adulti sani. La sospensione e la compressa sono simili nella loro biodisponibilità sia per il losartan che per il metabolita attivo [vedi DOSAGGIO E SOMMINISTRAZIONE ] .
Geriatrico e di genere
La farmacocinetica del losartan è stata studiata negli anziani (65-75 anni) e in entrambi i sessi. Le concentrazioni plasmatiche di losartan e del suo metabolita attivo sono simili negli ipertesi anziani e giovani. Le concentrazioni plasmatiche di losartan erano circa il doppio nelle donne ipertensive rispetto a quelle maschili, ma le concentrazioni del metabolita attivo erano simili nei maschi e nelle femmine. Non è necessario alcun aggiustamento del dosaggio [vedi DOSAGGIO E SOMMINISTRAZIONE ] .
Gara
Le differenze farmacocinetiche dovute alla razza non sono state studiate [vedi Utilizzare in popolazioni specifiche ] .
Insufficienza renale
Dopo somministrazione orale, le concentrazioni plasmatiche e le AUC di losartan e del suo metabolita attivo sono aumentate del 50-90% nei pazienti con insufficienza renale lieve (clearance della creatinina da 50 a 74 ml/min) o moderata (clearance della creatinina da 30 a 49 ml/min). . In questo studio, la clearance renale è stata ridotta del 55-85% sia per losartan che per il suo metabolita attivo in pazienti con insufficienza renale lieve o moderata. Né il losartan né il suo metabolita attivo possono essere rimossi mediante emodialisi [vedi AVVERTENZE E PRECAUZIONI e Utilizzare in popolazioni specifiche ] .
Insufficienza epatica
Dopo somministrazione orale in pazienti con cirrosi alcolica epatica da lieve a moderata, le concentrazioni plasmatiche di losartan e del suo metabolita attivo erano, rispettivamente, 5 volte e circa 1,7 volte quelle dei giovani volontari maschi. Rispetto ai soggetti normali, la clearance plasmatica totale dei pazienti ricoverati con losartan con insufficienza epatica era inferiore di circa il 50% e la biodisponibilità orale era circa raddoppiata. Utilizzare una dose iniziale di 25 mg per i pazienti con insufficienza epatica da lieve a moderata. COZAAR 50 mg non è stato studiato in pazienti con grave insufficienza epatica [vedi DOSAGGIO E SOMMINISTRAZIONE e Utilizzare in popolazioni specifiche ] .
Interazioni farmacologiche
Non sono state riscontrate interazioni farmacologiche clinicamente significative negli studi di losartan potassico con idroclorotiazide, digossina, warfarin, cimetidina e fenobarbital. Tuttavia, è stato dimostrato che la rifampicina riduce l'AUC di losartan e del suo metabolita attivo rispettivamente del 30% e del 40%. Il fluconazolo, un inibitore del citocromo P450 2C9, ha ridotto l'AUC del metabolita attivo di circa il 40%, ma ha aumentato l'AUC di losartan di circa il 70% dopo dosi multiple. La conversione di losartan nel suo metabolita attivo dopo somministrazione endovenosa non è influenzata dal ketoconazolo, un inibitore di P450 3A4. L'AUC del metabolita attivo dopo losartan orale non è stata influenzata dall'eritromicina, un inibitore di P450 3A4, ma l'AUC del losartan è stata aumentata del 30%.
Le conseguenze farmacodinamiche dell'uso concomitante di losartan e inibitori di P450 2C9 non sono state esaminate. È stato dimostrato che i soggetti che non metabolizzano losartan nel metabolita attivo hanno uno specifico e raro difetto nel citocromo P450 2C9. Questi dati suggeriscono che la conversione del losartan nel suo metabolita attivo è mediata principalmente da P450 2C9 e non da P450 3A4.
Studi clinici
Ipertensione
Ipertensione adulta
Gli effetti antiipertensivi di COZAAR 25 mg sono stati dimostrati principalmente in 4 studi controllati con placebo, da 6 a 12 settimane, con dosaggi da 10 a 150 mg al giorno in pazienti con pressione diastolica basale di 95-115. Gli studi hanno consentito il confronto di due dosi (50-100 mg/die) come regimi una volta al giorno o due volte al giorno, il confronto degli effetti di picco e minimo e il confronto della risposta per sesso, età e razza. Tre ulteriori studi hanno esaminato gli effetti antipertensivi di losartan e idroclorotiazide in combinazione.
4 studi di losartan in monoterapia includevano un totale di 1075 pazienti randomizzati a diverse dosi di losartan e 334 al placebo. Le dosi da 10 e 25 mg hanno prodotto qualche effetto al picco (6 ore dopo la somministrazione) ma risposte minime e inconsistenti (24 ore). Dosi di 50, 100 e 150 mg una volta al giorno hanno prodotto riduzioni medie della pressione arteriosa sistolica/diastolica statisticamente significative, rispetto al placebo nell'intervallo 5,5-10,5/3,5-7,5 mmHg, con la dose di 150 mg che non ha dato un effetto maggiore di 50- 100 mg. La somministrazione due volte al giorno a 50-100 mg/die ha dato risposte minime costantemente maggiori rispetto alla somministrazione una volta al giorno alla stessa dose totale. Gli effetti di picco (6 ore) erano uniformemente, ma moderatamente, maggiori degli effetti di depressione, con il rapporto minimo-picco per le risposte sistoliche e diastoliche rispettivamente del 50-95% e del 60-90%.
L'aggiunta di una bassa dose di idroclorotiazide (12,5 mg) a losartan 50 mg una volta al giorno ha comportato una riduzione della pressione sanguigna aggiustata con il placebo di 15,5/9,2 mmHg.
L'analisi dei sottogruppi di pazienti per età, sesso e razza ha mostrato che uomini e donne e pazienti di età superiore e inferiore a 65 anni hanno generalmente risposte simili. COZAAR 25 mg è stato efficace nel ridurre la pressione sanguigna indipendentemente dalla razza, sebbene l'effetto fosse leggermente inferiore nei pazienti neri (di solito una popolazione a bassa renina).
Ipertensione Pediatrica
L'effetto antipertensivo di losartan è stato studiato in uno studio che ha arruolato 177 pazienti pediatrici ipertesi di età compresa tra 6 e 16 anni. I bambini di peso DOSAGGIO E SOMMINISTRAZIONE . La maggior parte dei bambini presentava ipertensione associata a malattie renali e urogenitali. La pressione diastolica in posizione seduta (SiDBP) all'ingresso nello studio era superiore al livello del 95° percentile per età, sesso e altezza del paziente. Alla fine delle tre settimane, losartan ha ridotto la pressione sistolica e diastolica, misurata al minimo, in modo dose-dipendente. Complessivamente, le due dosi più elevate (da 25 a 50 mg nei pazienti
Pazienti ipertesi con ipertrofia ventricolare sinistra
Lo studio LIFE è stato uno studio multinazionale in doppio cieco che ha confrontato COZAAR 50 mg e atenololo in 9193 pazienti ipertesi con ipertrofia ventricolare sinistra documentata da ECG. Sono stati esclusi i pazienti con infarto del miocardio o ictus nei sei mesi precedenti la randomizzazione. I pazienti sono stati randomizzati a ricevere una volta al giorno COZAAR 50 mg o atenololo 50 mg. Se la pressione arteriosa obiettivo (
Dei pazienti randomizzati, 4963 (54%) erano donne e 533 (6%) erano neri. L'età media era 67 con 5704 (62%) età ≥65. Al basale, 1195 (13%) avevano il diabete, 1326 (14%) avevano ipertensione sistolica isolata, 1469 (16%) avevano una malattia coronarica e 728 (8%) avevano una malattia cerebrovascolare. La pressione sanguigna media al basale era 174/98 mmHg in entrambi i gruppi di trattamento. La durata media del follow-up è stata di 4,8 anni. Alla fine dello studio o all'ultima visita prima di un endpoint primario, il 77% del gruppo trattato con COZAAR 50 mg e il 73% del gruppo trattato con atenololo stavano ancora assumendo il farmaco in studio. Dei pazienti che stavano ancora assumendo il farmaco in studio, le dosi medie di COZAAR e atenololo erano entrambe di circa 80 mg/die e il 15% stava assumendo atenololo o losartan in monoterapia, mentre il 77% stava assumendo anche idroclorotiazide (a una dose media di 20 mg/die in ciascun gruppo). La riduzione della pressione sanguigna misurata alla depressione era simile per entrambi i gruppi di trattamento, ma la pressione sanguigna non è stata misurata in nessun altro momento della giornata. Alla fine dello studio o all'ultima visita prima di un endpoint primario, la pressione arteriosa media era 144,1/81,3 mmHg per il gruppo trattato con COZAAR e 145,4/80,9 mmHg per il gruppo trattato con atenololo; la differenza nella pressione arteriosa sistolica (SBP) di 1,3 mmHg era significativa (p
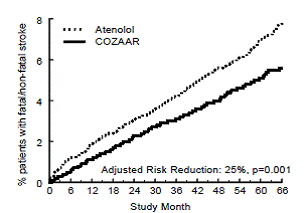
L'endpoint primario era la prima occorrenza di morte cardiovascolare, ictus non fatale o infarto del miocardio non fatale. I pazienti con eventi non fatali sono rimasti nello studio, cosicché è stato esaminato anche il primo evento di ogni tipo anche se non era il primo evento (p. es., un ictus successivo a un infarto miocardico iniziale sarebbe stato conteggiato nell'analisi dell'ictus). Il trattamento con COZAAR 50 mg ha comportato una riduzione del 13% (p=0,021) del rischio dell'endpoint primario rispetto al gruppo atenololo (vedere Figura 1 e Tabella 3); questa differenza era principalmente il risultato di un effetto sull'ictus fatale e non fatale. Il trattamento con COZAAR ha ridotto il rischio di ictus del 25% rispetto all'atenololo (p=0,001) (vedere la Figura 2 e la Tabella 3).
Figura 1: Stime di Kaplan-Meier dell'endpoint primario del tempo alla morte cardiovascolare, ictus non fatale o infarto del miocardio non fatale nei gruppi trattati con COZAAR 100 mg e atenololo. La riduzione del rischio è aggiustata per il punteggio di rischio di Framingham basale e il livello di ipertrofia ventricolare sinistra elettrocardiografica
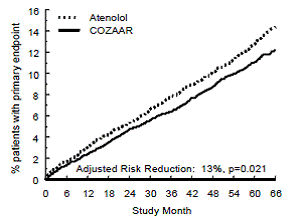
Figura 2: stime di Kaplan-Meier del tempo all'ictus fatale/non fatale nei gruppi trattati con COZAAR 50 mg e atenololo. La riduzione del rischio è aggiustata per il punteggio di rischio di Framingham basale e il livello di ipertrofia ventricolare sinistra elettrocardiografica
La tabella 3 mostra i risultati per l'endpoint composito primario e per i singoli endpoint. L'endpoint primario era la prima occorrenza di ictus, infarto del miocardio o morte cardiovascolare, analizzata utilizzando un approccio ITT. La tabella mostra il numero di eventi per ciascun componente in due modi diversi. I componenti dell'endpoint primario (come primo evento) contano solo gli eventi che definiscono l'endpoint primario, mentre gli endpoint secondari contano tutti i primi eventi di un particolare tipo, indipendentemente dal fatto che siano stati preceduti o meno da un diverso tipo di evento.
Sebbene lo studio LIFE abbia favorito il COZAAR rispetto all'atenololo rispetto all'endpoint primario (p=0,021), questo risultato proviene da un singolo studio e, pertanto, è meno convincente della differenza tra COZAAR e placebo. Sebbene non sia misurata direttamente, la differenza tra COZAAR e placebo è convincente perché ci sono prove che l'atenololo è di per sé efficace (rispetto al placebo) nel ridurre gli eventi cardiovascolari, incluso l'ictus, nei pazienti ipertesi.
Altri endpoint clinici dello studio LIFE erano: mortalità totale, ospedalizzazione per insufficienza cardiaca o angina pectoris, procedure di rivascolarizzazione coronarica o periferica e arresto cardiaco rianimato. Non ci sono state differenze significative nei tassi di questi endpoint tra i gruppi COZAAR e atenololo.
Per l'endpoint primario e l'ictus, gli effetti di COZAAR 25 mg in sottogruppi di pazienti definiti da età, sesso, razza e presenza o assenza di ipertensione sistolica isolata (ISH), diabete e storia di malattie cardiovascolari (CVD) sono mostrati nella Figura 3 di seguito . Le analisi dei sottogruppi possono essere difficili da interpretare e non è noto se rappresentino differenze reali o effetti casuali.
Figura 3: Eventi degli endpoint primari† all'interno dei sottogruppi demografici
Nefropatia nei pazienti diabetici di tipo 2
Lo studio RENAAL era uno studio multicentrico, randomizzato, controllato con placebo, in doppio cieco, condotto in tutto il mondo su 1513 pazienti affetti da diabete di tipo 2 con nefropatia (definita come creatinina sierica da 1,3 a 3,0 mg/dL nelle femmine o nei maschi ≤60 kg e da 1,5 a 3,0 mg /dL nei maschi >60 kg e proteinuria [rapporto albumina urinaria/creatinina ≥300 mg/g]).
pazienti sono stati randomizzati a ricevere COZAAR 50 mg una volta al giorno o placebo in un contesto di terapia antipertensiva convenzionale escludendo gli ACE-inibitori e gli antagonisti dell'angiotensina II. Dopo un mese, ai ricercatori è stato chiesto di titolare il farmaco in studio a 100 mg una volta al giorno se l'obiettivo della pressione arteriosa minima (140/90 mmHg) non era stato raggiunto. Complessivamente, il 72% dei pazienti ha ricevuto la dose giornaliera di 100 mg più del 50% del tempo in cui era in trattamento con il farmaco in studio. Poiché lo studio è stato progettato per ottenere un uguale controllo della pressione sanguigna in entrambi i gruppi, altri agenti antipertensivi (diuretici, calcio-antagonisti, alfa o beta-bloccanti e agenti ad azione centrale) potrebbero essere aggiunti secondo necessità in entrambi i gruppi. I pazienti sono stati seguiti per una durata media di 3,4 anni.
La popolazione in studio era diversificata per quanto riguarda la razza (asiatica 16,7%, nera 15,2%, ispanica 18,3%, bianca 48,6%). Complessivamente, il 63,2% dei pazienti erano uomini e il 66,4% aveva meno di 65 anni. Quasi tutti i pazienti (96,6%) avevano una storia di ipertensione ei pazienti sono entrati nello studio con una creatinina sierica media di 1,9 mg/dl e una proteinuria media (albumina urinaria/creatinina) di 1808 mg/g al basale.
L'endpoint primario dello studio era il tempo alla prima insorgenza di uno qualsiasi dei seguenti eventi: raddoppio della creatinina sierica, malattia renale allo stadio terminale (ESRD) (necessità di dialisi o trapianto) o morte. Il trattamento con COZAAR ha comportato una riduzione del rischio del 16% in questo endpoint (vedere Figura 4 e Tabella 4). Il trattamento con COZAAR ha anche ridotto l'occorrenza del raddoppio prolungato della creatinina sierica del 25% e dell'ESRD del 29% come endpoint separati, ma non ha avuto effetto sulla mortalità complessiva (vedere Tabella 4).
La pressione arteriosa media al basale era 152/82 mmHg per COZAAR più terapia antipertensiva convenzionale e 153/82 mmHg per placebo più terapia antipertensiva convenzionale. Al termine dello studio, la pressione arteriosa media era 143/76 mmHg per il gruppo trattato con COZAAR 100 mg e 146/77 mmHg per il gruppo trattato con placebo.
Figura 4: Curva di Kaplan-Meier per l'endpoint composito primario di raddoppio della creatinina sierica, malattia renale allo stadio terminale (necessità di dialisi o trapianto) o morte
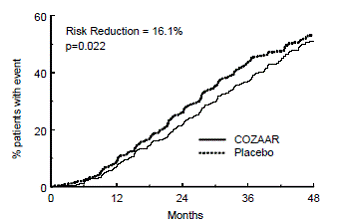
Gli endpoint secondari dello studio erano il cambiamento nella proteinuria, il cambiamento nel tasso di progressione della malattia renale e il composito di morbilità e mortalità per cause cardiovascolari (ospedalizzazione per insufficienza cardiaca, infarto miocardico, rivascolarizzazione, ictus, ospedalizzazione per angina instabile o cardiovascolare rispetto al placebo, COZAAR ha ridotto significativamente la proteinuria in media del 34%, un effetto che era evidente entro 3 mesi dall'inizio della terapia, e ha ridotto significativamente del 13% il tasso di diminuzione della velocità di filtrazione glomerulare durante lo studio, come misurato da il reciproco della concentrazione di creatinina sierica. Non vi era alcuna differenza significativa nell'incidenza dell'endpoint composito di morbilità e mortalità cardiovascolare.
Gli effetti favorevoli di COZAAR sono stati osservati in pazienti che assumevano anche altri farmaci antipertensivi (non erano ammessi antagonisti del recettore dell'angiotensina II e inibitori dell'enzima di conversione dell'angiotensina), agenti ipoglicemizzanti orali e agenti ipolipemizzanti.
Per l'endpoint primario e l'ESRD, gli effetti di COZAAR nei sottogruppi di pazienti definiti da età, sesso e razza sono riportati nella Tabella 5 di seguito. Le analisi dei sottogruppi possono essere difficili da interpretare e non è noto se rappresentino differenze reali o effetti casuali.
INFORMAZIONI PER IL PAZIENTE
COZAAR® (CO-zar) (compresse di losartan potassio) 25 mg, 50 mg, 100 mg
Leggi le informazioni per il paziente fornite con COZAAR prima di iniziare a prenderlo e ogni volta che ricevi una ricarica. Potrebbero esserci nuove informazioni. Questo foglio illustrativo non sostituisce il parlare con il medico della sua condizione e del trattamento.
Qual è l'informazione più importante che dovrei sapere su COZAAR?
- COZAAR può causare danni o morte a un nascituro.
- Parla con il tuo medico di altri modi per abbassare la pressione sanguigna se hai intenzione di rimanere incinta.
- Se rimane incinta durante l'assunzione di COZAAR, informi immediatamente il medico.
Cos'è COZAAR 100 mg?
COZAAR 100 mg è un medicinale soggetto a prescrizione chiamato bloccante del recettore dell'angiotensina (ARB). È solito:
- da solo o con altri medicinali per la pressione sanguigna per abbassare la pressione alta (ipertensione).
- per ridurre la possibilità di ictus nei pazienti con pressione alta e un problema cardiaco chiamato ipertrofia ventricolare sinistra. COZAAR potrebbe non aiutare i pazienti neri con questo problema.
- per rallentare il peggioramento della malattia renale diabetica (nefropatia) nei pazienti con diabete di tipo 2 che hanno o avevano la pressione alta.
COZAAR 25 mg non è stato studiato nei bambini di età inferiore a 6 anni o nei bambini con determinati problemi renali.
Alta pressione sanguigna (ipertensione) La pressione sanguigna è la forza nei vasi sanguigni quando il cuore batte e quando il cuore riposa. Hai la pressione alta quando la forza è eccessiva. COZAAR 25 mg può aiutare i vasi sanguigni a rilassarsi in modo che la pressione sanguigna sia più bassa.
Ipertrofia ventricolare sinistra (LVH) è un allargamento delle pareti della camera sinistra del cuore (la principale camera di pompaggio del cuore). LVH può succedere da molte cose. La pressione alta è la causa più comune di LVH.
Diabete di tipo 2 con nefropatia . Il diabete di tipo 2 è un tipo di diabete che si verifica principalmente negli adulti. Se hai la nefropatia diabetica significa che i tuoi reni non funzionano correttamente a causa dei danni causati dal diabete.
Chi non dovrebbe assumere COZAAR 100 mg?
- Non prenda COZAAR 25 mg se è allergico a uno qualsiasi degli eccipienti di COZAAR . Vedere la fine di questo foglio illustrativo per un elenco completo degli ingredienti in COZAAR.
- Non prenda COZAAR se ha il diabete e sta assumendo un medicinale chiamato aliskiren per ridurre la pressione sanguigna.
Cosa devo dire al mio medico prima di prendere COZAAR 50 mg?
Informi il medico di tutte le sue condizioni mediche, incluso se:
- sono incinta o stanno pianificando una gravidanza. Vedere " Qual è l'informazione più importante che dovrei sapere su COZAAR 25mg? "
- stanno allattando . Non è noto se COZAAR 50 mg passi nel latte materno. Dovresti scegliere se assumere COZAAR 50 mg o allattare, ma non entrambi.
- stanno vomitando molto o hanno molta diarrea
- ha problemi al fegato
- ha problemi ai reni
Informa il tuo medico di tutti i medicinali che assumi, inclusi medicinali soggetti a prescrizione e senza prescrizione medica, vitamine e integratori a base di erbe. COZAAR e alcuni altri medicinali possono interagire tra loro. In particolare informi il medico se sta assumendo:
- integratori di potassio
- sostituti del sale contenenti potassio
- altri medicinali che possono aumentare il potassio sierico
- pillole d'acqua (diuretici)
- litio (un medicinale usato per trattare un certo tipo di depressione)
- medicinali usati per trattare il dolore e l'artrite, chiamati farmaci antinfiammatori non steroidei (FANS), compresi gli inibitori della COX-2
- altri medicinali per ridurre la pressione sanguigna
Come devo prendere COZAAR 25mg?
- Prenda COZAAR 100 mg esattamente come prescritto dal medico. Il medico può modificare la dose se necessario.
- COZAAR 50 mg può essere assunto con o senza cibo.
- Se dimentica una dose, la prenda non appena se ne ricorda. Se è vicino alla dose successiva, non prenda la dose dimenticata. Prenda la dose successiva all'orario abituale.
- Se prendi troppo COZAAR, chiama il medico o il Centro antiveleni o vai subito al pronto soccorso dell'ospedale più vicino.
Quali sono i possibili effetti collaterali di COZAAR?
COZAAR 25 mg può causare i seguenti effetti collaterali che possono essere gravi:
- Ferita o morte di bambini non ancora nati. Vedi "Qual è l'informazione più importante che dovrei sapere su COZAAR?"
- Reazione allergica I sintomi di una reazione allergica sono gonfiore del viso, delle labbra, della gola o della lingua. Ottenere immediatamente assistenza medica di emergenza e interrompere l'assunzione di COZAAR.
- Bassa pressione sanguigna (ipotensione) . La bassa pressione sanguigna può causare svenimento o vertigini. Sdraiati se ti senti debole o stordito. Chiama subito il tuo medico.
- Per le persone che hanno già problemi ai reni, potresti vedere un peggioramento del funzionamento dei tuoi reni. Chiama il tuo medico se hai gonfiore ai piedi, alle caviglie o alle mani o un aumento di peso inspiegabile.
- Alti livelli ematici di potassio
Gli effetti collaterali più comuni di COZAAR 50 mg nelle persone con pressione alta sono:
- "raffreddore" (infezione delle vie respiratorie superiori)
- vertigini
- naso tappato
- mal di schiena
Gli effetti collaterali più comuni di COZAAR 50 mg nelle persone con diabete di tipo 2 con malattia renale diabetica sono:
- diarrea
- stanchezza
- basso livello di zucchero nel sangue
- dolore al petto
- potassio nel sangue alto
- bassa pressione sanguigna
Informi il medico se si verificano effetti collaterali che ti infastidiscono o che non scompaiono.
Questo è non un elenco completo degli effetti collaterali. Per un elenco completo, chiedi al tuo medico o farmacista.
Come conservo COZAAR 100 mg?
- Conservare le compresse di COZAAR a una temperatura compresa tra 59°F e 86°F (da 15°C a 30°C).
- Conservare COZAAR in un contenitore ben chiuso che protegga il medicinale dalla luce.
- Tenere COZAAR e tutti i medicinali fuori dalla portata dei bambini.
Informazioni generali su COZAAR
Talvolta vengono prescritti medicinali per condizioni che non sono menzionate nei fogli informativi per i pazienti. Non utilizzare COZAAR per una condizione per la quale non è stato prescritto. Non somministrare COZAAR ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Questo opuscolo riassume le informazioni più importanti su COZAAR. Se desideri maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo farmacista o al tuo medico informazioni su COZAAR scritte per gli operatori sanitari.
Quali sono gli ingredienti di COZAAR 25mg?
Ingredienti attivi: losartan potassio
Ingredienti inattivi:
cellulosa microcristallina, lattosio idrato, amido pregelatinizzato, magnesio stearato, idrossipropilcellulosa, ipromellosa e biossido di titanio. COZAAR 25 mg, COZAAR 50 mg e COZAAR 100 mg possono contenere anche cera di carnauba.
