Catapres 100mcg Clonidine Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Cos'è Catapres e come si usa?
Catapres è un medicinale su prescrizione usato per trattare i sintomi dell'ipertensione, del disturbo da deficit di attenzione e iperattività (ADHD) e del dolore da cancro. Catapres 100mcg può essere usato da solo o con altri farmaci.
Catapres 100mcg appartiene a una classe di farmaci chiamati Alpha2 Agonists, Central-Acting, ADHD Agents.
Non è noto se Catapres 100 mcg sia sicuro ed efficace nei bambini di età inferiore ai 12 anni.
Quali sono i possibili effetti collaterali di Catapres?
Catapres può causare gravi effetti collaterali tra cui:
- sintomi di astinenza,
- nervosismo,
- agitazione,
- male alla testa,
- tremore, e
- rapido aumento della pressione sanguigna
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Catapres 100mcg includono:
- bocca asciutta,
- vertigini,
- sonnolenza,
- fatica,
- stipsi,
- male alla testa,
- nausea, e
- disturbi del sonno (insonnia)
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Catapres. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
Catapres® (clonidina cloridrato, USP) è un agente ipotensivo alfa-agonista ad azione centrale disponibile sotto forma di compresse per somministrazione orale in tre dosaggi: 0,1 mg, 0,2 mg e 0,3 mg. La compressa da 0,1 mg equivale a 0,087 mg di base libera.
Gli ingredienti inattivi sono biossido di silicio colloidale, amido di mais, fosfato di calcio bibasico, FD&C Yellow n. 6, gelatina, glicerina, lattosio e magnesio stearato. La compressa Catapres da 0,1 mg contiene anche FD&C Blue No.1 e FD&C Red No.3.
La clonidina cloridrato è un derivato dell'imidazolina ed esiste come composto mesomerico. Il nome chimico è 2-(2,6-diclorofenilammino)-2-imidazolina cloridrato. Quella che segue è la formula strutturale:
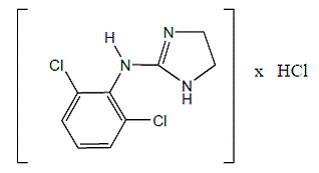 C9H9Cl2N3 · HCl mol. wt. 266.56
C9H9Cl2N3 · HCl mol. wt. 266.56 La clonidina cloridrato è una sostanza cristallina inodore, amara, bianca, solubile in acqua e alcol.
INDICAZIONI
Le compresse di CATAPRES sono indicate nel trattamento dell'ipertensione. Le compresse di CATAPRES possono essere utilizzate da sole o in concomitanza con altri agenti antipertensivi.
DOSAGGIO E SOMMINISTRAZIONE
Adulti
La dose di Catapres® (clonidina cloridrato, USP) compresse deve essere aggiustata in base alla risposta pressoria individuale del paziente. Quella che segue è una guida generale alla sua amministrazione.
Dose iniziale
Compressa da 0,1 mg due volte al giorno (mattina e prima di coricarsi). I pazienti anziani possono trarre beneficio da una dose iniziale più bassa.
Dose di mantenimento
Se necessario, possono essere effettuati ulteriori incrementi di 0,1 mg al giorno a intervalli settimanali fino al raggiungimento della risposta desiderata. L'assunzione della porzione più ampia della dose giornaliera orale prima di coricarsi può ridurre al minimo gli effetti transitori di aggiustamento della secchezza delle fauci e della sonnolenza. Le dosi terapeutiche più comunemente impiegate sono variate da 0,2 mg a 0,6 mg al giorno somministrate in dosi frazionate. Gli studi hanno indicato che 2,4 mg è la dose giornaliera massima efficace, ma raramente sono state impiegate dosi così elevate.
Insufficienza renale
I pazienti con insufficienza renale possono trarre beneficio da una dose iniziale più bassa. I pazienti devono essere attentamente monitorati. Poiché durante l'emodialisi di routine viene rimossa solo una quantità minima di clonidina, non è necessario somministrare clonidina supplementare dopo la dialisi.
COME FORNITO
Le compresse Catapres® (clonidina cloridrato, USP) sono fornite come segue:
Conservare a 25°C (77°F); escursioni consentite a 15°-30°C (59°-86°F) [vedere Temperatura ambiente controllata USP ].
Dispensare in un contenitore stretto e resistente alla luce.
Distribuito da: Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 USA. Prodotto da: Boehringer Ingelheim Promeco SA de CV, Città del Messico, Messico. Concesso in licenza da: Boehringer Ingelheim, International GmbH, Rivolgersi alle richieste mediche a: (800) 542-6257 o (800) 459-9906. Revisionato: maggio 2012
EFFETTI COLLATERALI
La maggior parte degli effetti avversi sono lievi e tendono a diminuire con il proseguimento della terapia. I più frequenti (che sembrano essere dose-correlati) sono la secchezza delle fauci, che si verifica in circa 40 pazienti su 100; sonnolenza, circa 33 su 100; vertigini, circa 16 su 100; costipazione e sedazione, ciascuna circa 10 su 100.
Le seguenti esperienze avverse meno frequenti sono state riportate anche in pazienti che ricevevano CATAPRES 100 mcg compresse, ma in molti casi i pazienti stavano assumendo farmaci concomitanti e non è stata stabilita una relazione causale.
Corpo nel suo insieme: Stanchezza, febbre, mal di testa, pallore, debolezza e sindrome da astinenza. Sono stati anche segnalati un test di Coombs debolmente positivo e una maggiore sensibilità all'alcol.
Cardiovascolare: Bradicardia, insufficienza cardiaca congestizia, anomalie elettrocardiografiche (es. arresto del nodo del seno, bradicardia giunzionale, blocco atrioventricolare di alto grado e aritmie), sintomi ortostatici, palpitazioni, fenomeno di Raynaud, sincope e tachicardia. Sono stati segnalati casi di bradicardia sinusale e blocco atrioventricolare, sia con che senza l'uso concomitante di digitale.
Sistema nervoso centrale: Agitazione, ansia, delirio, percezione delirante, allucinazioni (incluse visive e uditive), insonnia, depressione mentale, nervosismo, altri cambiamenti comportamentali, parestesie, irrequietezza, disturbi del sonno e sogni o incubi vividi.
Dermatologico: Alopecia, edema angioneurotico, orticaria, prurito, eruzione cutanea e orticaria.
Gastrointestinale: Dolore addominale, anoressia, costipazione, epatite, malessere, lievi anomalie transitorie nei test di funzionalità epatica, nausea, parotite, pseudo-ostruzione (inclusa pseudo-ostruzione del colon), dolore alle ghiandole salivari e vomito.
Genito-urinario: Diminuzione dell'attività sessuale, difficoltà nella minzione, disfunzione erettile, perdita della libido, nicturia e ritenzione urinaria.
Ematologico: Trombocitopenia.
metabolico: Ginecomastia, aumento transitorio della glicemia o della creatinfosfochinasi sierica e aumento di peso.
Muscoloscheletrico: Crampi alle gambe e dolori muscolari o articolari.
Oro-otorinolaringoiatria: Secchezza della mucosa nasale.
Oftalmologico: Disturbo dell'accomodazione, visione offuscata, bruciore agli occhi, diminuzione della lacrimazione e secchezza degli occhi.
INTERAZIONI DI DROGA
La clonidina può potenziare gli effetti depressivi sul SNC di alcol, barbiturici o altri farmaci sedativi. Se un paziente che riceve clonidina cloridrato sta assumendo anche antidepressivi triciclici, l'effetto ipotensivo della clonidina può essere ridotto, rendendo necessario un aumento della dose di clonidina. Se un paziente in trattamento con clonidina sta assumendo anche neurolettici, possono essere indotti o esacerbati disturbi della regolazione ortostatica (p. es., ipotensione ortostatica, vertigini, affaticamento).
Monitorare la frequenza cardiaca nei pazienti che ricevono clonidina in concomitanza con agenti noti per influenzare la funzione del nodo senoatriale o la conduzione del nodo atrioventricolare, ad es. digitale, calcio-antagonisti e beta-bloccanti. È stata segnalata bradicardia sinusale con conseguente ricovero in ospedale e inserimento di pacemaker in associazione all'uso di clonidina in concomitanza con diltiazem o verapamil.
L'amitriptilina in combinazione con la clonidina aumenta la manifestazione delle lesioni corneali nei ratti (vedi Tossicologia ).
Sulla base delle osservazioni in pazienti in stato di delirio alcolico, è stato suggerito che dosi elevate di clonidina per via endovenosa possono aumentare il potenziale aritmogeno (prolungamento del QT, fibrillazione ventricolare) di dosi elevate di aloperidolo per via endovenosa. La relazione causale e la rilevanza per le compresse orali di clonidina non sono state stabilite.
AVVERTENZE
Ritiro
pazienti devono essere istruiti a non interrompere la terapia senza consultare il proprio medico. L'interruzione improvvisa del trattamento con clonidina, in alcuni casi, ha dato luogo a sintomi quali nervosismo, agitazione, mal di testa e tremore accompagnati o seguiti da un rapido aumento della pressione sanguigna e concentrazioni elevate di catecolamine nel plasma. La probabilità di tali reazioni all'interruzione della terapia con clonidina sembra essere maggiore dopo la somministrazione di dosi più elevate o la continuazione del trattamento concomitante con beta-bloccanti e pertanto si consiglia particolare cautela in queste situazioni. Dopo la sospensione della clonidina sono stati segnalati rari casi di encefalopatia ipertensiva, incidenti cerebrovascolari e morte. Quando si interrompe la terapia con CATAPRES compresse, il medico deve ridurre la dose gradualmente nell'arco di 2-4 giorni per evitare la sintomatologia da astinenza.
Un aumento eccessivo della pressione sanguigna dopo l'interruzione della terapia con CATAPRES 100 mcg compresse può essere annullato con la somministrazione di clonidina cloridrato orale o con fentolamina per via endovenosa. Se la terapia deve essere interrotta in pazienti che ricevono contemporaneamente un beta-bloccante e clonidina, il beta-bloccante deve essere sospeso diversi giorni prima dell'interruzione graduale di CATAPRES 100 mcg compresse.
Poiché i bambini hanno comunemente malattie gastrointestinali che portano al vomito, possono essere particolarmente suscettibili agli episodi ipertensivi derivanti dall'improvvisa incapacità di assumere farmaci.
PRECAUZIONI
Generale
Nei pazienti che hanno sviluppato una sensibilizzazione da contatto localizzata a Catapres-TTS® (clonidina), la continuazione di Catapres-TTS o la sostituzione della terapia orale con clonidina cloridrato può essere associata allo sviluppo di un'eruzione cutanea generalizzata.
Nei pazienti che sviluppano una reazione allergica a Catapres-TTS, anche la sostituzione orale di clonidina cloridrato può provocare una reazione allergica (inclusi rash generalizzato, orticaria o angioedema).
L'azione simpaticolitica della clonidina può peggiorare la disfunzione del nodo del seno e il blocco atrioventricolare (AV), specialmente nei pazienti che assumono altri farmaci simpaticolitici. Vi sono segnalazioni post-marketing di pazienti con anomalie della conduzione e/o che assumevano altri farmaci simpaticolitici che hanno sviluppato una grave bradicardia che ha richiesto atropina EV, isoproterenolo EV e stimolazione cardiaca temporanea durante l'assunzione di clonidina.
Nell'ipertensione causata da feocromocitoma, non ci si può aspettare alcun effetto terapeutico di CATAPRES 100 mcg compresse.
Uso perioperatorio
La somministrazione delle compresse di Catapres® (clonidina cloridrato, USP) deve essere continuata entro 4 ore dall'intervento e ripresa il prima possibile in seguito. La pressione sanguigna deve essere attentamente monitorata durante l'intervento chirurgico e, se necessario, devono essere disponibili misure aggiuntive per controllare la pressione sanguigna.
Cancerogenesi, mutagenesi, compromissione della fertilità
La somministrazione dietetica cronica di clonidina non è risultata cancerogena per ratti (132 settimane) o topi (78 settimane), rispettivamente a dosi fino a 46 o 70 volte la dose massima giornaliera raccomandata nell'uomo in mg/kg (9 o 6 volte la MRDHD su un mg/m²). Non c'era evidenza di genotossicità nel test di Ames per la mutagenicità o nel test del micronucleo del topo per la clastogenicità.
La fertilità di ratti maschi o femmine non è stata influenzata da dosi di clonidina fino a 150 μg/kg (circa 3 volte MRDHD). In un esperimento separato, la fertilità delle femmine di ratto sembrava essere influenzata a livelli di dose da 500 a 2000 μg/kg (da 10 a 40 volte la MRDHD orale su base mg/kg; da 2 a 8 volte la MRDHD su base mg/m² ).
Gravidanza
Effetti teratogeni
Gravidanza Categoria C
Gli studi sulla riproduzione condotti nei conigli a dosi fino a circa 3 volte la dose umana giornaliera massima raccomandata per via orale (MRDHD) di Catapres® (clonidina cloridrato, USP) compresse non hanno prodotto evidenza di potenziale teratogeno o embriotossico nei conigli. Nei ratti, tuttavia, dosi fino a 1/3 dell'MRDHD orale (1/15 dell'MRDHD su base mg/m²) di clonidina sono state associate a un aumento del riassorbimento in uno studio in cui le madri sono state trattate continuamente da 2 mesi prima dell'accoppiamento . L'aumento del riassorbimento non è stato associato al trattamento contemporaneamente o a livelli di dose più elevati (fino a 3 volte la MRDHD orale) quando le madri sono state trattate nei giorni di gestazione da 6 a 15. Sono stati osservati aumenti di riassorbimento a livelli di dose molto più elevati (40 volte la MRDHD orale su base mg/kg; da 4 a 8 volte la MRDHD su base mg/m²) nei topi e nei ratti trattati nei giorni di gestazione da 1 a 14 (la dose più bassa impiegata nello studio era 500 μg/kg).
Non sono stati condotti studi adeguati e ben controllati su donne in gravidanza. La clonidina attraversa la barriera placentare (vedi FARMACOLOGIA CLINICA , Farmacocinetica ). Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, questo farmaco deve essere usato durante la gravidanza solo se chiaramente necessario.
Madri che allattano
Poiché la clonidina cloridrato viene escreta nel latte materno, occorre prestare attenzione quando le compresse di CATAPRES 100 mcg vengono somministrate a una donna che allatta.
Uso pediatrico
La sicurezza e l'efficacia nei pazienti pediatrici non sono state stabilite in studi adeguati e ben controllati (vedi AVVERTENZE , Ritiro ).
OVERDOSE
L'ipertensione può svilupparsi precocemente e può essere seguita da ipotensione, bradicardia, depressione respiratoria, ipotermia, sonnolenza, riflessi ridotti o assenti, debolezza, irritabilità e miosi. La frequenza della depressione del SNC può essere maggiore nei bambini rispetto agli adulti. Grandi sovradosaggi possono causare difetti di conduzione cardiaca reversibili o aritmie, apnea, coma e convulsioni. Segni e sintomi di sovradosaggio si verificano generalmente entro 30 minuti o due ore dopo l'esposizione. Un minimo di 0,1 mg di clonidina ha prodotto segni di tossicità nei bambini.
Non esiste un antidoto specifico per il sovradosaggio di clonidina. Il sovradosaggio di clonidina può provocare il rapido sviluppo della depressione del SNC; pertanto, l'induzione del vomito con lo sciroppo di ipecac non è raccomandata. La lavanda gastrica può essere indicata a seguito di ingestione recente e/o di grandi dimensioni. La somministrazione di carbone attivo e/o catartico può essere utile. La terapia di supporto può includere atropina solfato per la bradicardia, liquidi per via endovenosa e/o agenti vasopressori per l'ipotensione e vasodilatatori per l'ipertensione. Il naloxone può essere un utile coadiuvante per la gestione della depressione respiratoria, dell'ipotensione e/o del coma indotta dalla clonidina; la pressione sanguigna deve essere monitorata poiché la somministrazione di naloxone ha occasionalmente provocato ipertensione paradossale. È improbabile che la dialisi migliori in modo significativo l'eliminazione della clonidina.
Il più grande sovradosaggio segnalato fino ad oggi ha coinvolto un maschio di 28 anni che ha ingerito 100 mg di clonidina cloridrato in polvere. Questo paziente ha sviluppato ipertensione seguita da ipotensione, bradicardia, apnea, allucinazioni, semicoma e contrazioni ventricolari premature. Il paziente si è completamente ripreso dopo un trattamento intensivo. I livelli plasmatici di clonidina erano 60 ng/ml dopo 1 ora, 190 ng/ml dopo 1,5 ore, 370 ng/ml dopo 2 ore e 120 ng/ml dopo 5,5 e 6,5 ore. Nei topi e nei ratti, la DL50 orale della clonidina è rispettivamente di 206 e 465 mg/kg.
CONTROINDICAZIONI
Le compresse di Catapres® (clonidina cloridrato, USP) non devono essere utilizzate in pazienti con nota ipersensibilità alla clonidina (vedi PRECAUZIONI ).
FARMACOLOGIA CLINICA
La clonidina stimola gli alfa-adrenergici nel tronco cerebrale. Questa azione si traduce in un ridotto deflusso simpatico dal sistema nervoso centrale e in una diminuzione della resistenza periferica, della resistenza vascolare renale, della frequenza cardiaca e della pressione sanguigna. Le compresse di CATAPRES 100mcg agiscono in modo relativamente rapido. La pressione sanguigna del paziente diminuisce entro 30-60 minuti dopo una dose orale, la diminuzione massima si verifica entro 2-4 ore. Il flusso sanguigno renale e la velocità di filtrazione glomerulare rimangono sostanzialmente invariati. I normali riflessi posturali sono intatti; pertanto, i sintomi ortostatici sono lievi e rari.
Studi acuti con clonidina cloridrato nell'uomo hanno dimostrato una moderata riduzione (dal 15% al 20%) della gittata cardiaca in posizione supina senza variazione della resistenza periferica: con un'inclinazione di 45° si ha una minore riduzione della gittata cardiaca e una diminuzione di resistenza periferica. Durante la terapia a lungo termine, la gittata cardiaca tende a tornare ai valori di controllo, mentre la resistenza periferica rimane ridotta. Nella maggior parte dei pazienti trattati con clonidina è stato osservato un rallentamento della frequenza cardiaca, ma il farmaco non altera la normale risposta emodinamica all'esercizio.
In alcuni pazienti può svilupparsi tolleranza all'effetto antipertensivo, rendendo necessaria una rivalutazione della terapia.
Altri studi su pazienti hanno fornito prove di una riduzione dell'attività della renina plasmatica e dell'escrezione di aldosterone e catecolamine. L'esatta relazione di queste azioni farmacologiche con l'effetto antipertensivo della clonidina non è stata completamente chiarita.
La clonidina stimola in modo acuto il rilascio dell'ormone della crescita sia nei bambini che negli adulti, ma non produce un aumento cronico dell'ormone della crescita con l'uso a lungo termine.
Farmacocinetica
La farmacocinetica della clonidina è proporzionale alla dose nell'intervallo da 100 a 600 μg. La biodisponibilità assoluta della clonidina per somministrazione orale va dal 70% all'80%. I livelli massimi di clonidina plasmatica vengono raggiunti in circa 1-3 ore.
Dopo somministrazione endovenosa, la clonidina mostra una disposizione bifasica con un'emivita di distribuzione di circa 20 minuti e un'emivita di eliminazione compresa tra 12 e 16 ore. L'emivita aumenta fino a 41 ore nei pazienti con grave compromissione della funzionalità renale. La clonidina attraversa la barriera placentare. È stato dimostrato che attraversa la barriera ematoencefalica nei ratti.
Dopo somministrazione orale, circa il 40-60% della dose assorbita viene recuperata nelle urine come farmaco immodificato in 24 ore. Circa il 50% della dose assorbita viene metabolizzata nel fegato. Né il cibo né la razza del paziente influenzano la farmacocinetica della clonidina.
L'effetto antipertensivo viene raggiunto a concentrazioni plasmatiche comprese tra circa 0,2 e 2,0 ng/mL in pazienti con normale funzione escretoria. Un ulteriore aumento dei livelli plasmatici non aumenterà l'effetto antipertensivo.
Tossicologia
In diversi studi con clonidina cloridrato orale, è stato osservato un aumento dose-dipendente dell'incidenza e della gravità della degenerazione retinica spontanea in ratti albini trattati per sei mesi o più. Studi sulla distribuzione tissutale nei cani e nelle scimmie hanno mostrato una concentrazione di clonidina nella coroide.
In considerazione della degenerazione retinica osservata nei ratti, sono stati effettuati esami oculistici durante studi clinici in 908 pazienti prima e periodicamente dopo l'inizio della terapia con clonidina. In 353 di questi 908 pazienti, le visite oculistiche sono state eseguite per periodi di 24 mesi o più. Fatta eccezione per una certa secchezza degli occhi, non sono stati registrati reperti oftalmologici anormali correlati al farmaco e, secondo test specializzati come l'elettroretinografia e l'abbagliamento maculare, la funzione retinica è rimasta invariata.
In combinazione con amitriptilina, la somministrazione di clonidina cloridrato ha portato allo sviluppo di lesioni corneali nei ratti entro 5 giorni.
INFORMAZIONI PER IL PAZIENTE
I pazienti devono essere avvertiti dell'interruzione della terapia con CATAPRES 100 mcg compresse senza il consiglio del medico.
Poiché i pazienti possono manifestare un possibile effetto sedativo, vertigini o disturbi dell'accomodazione con l'uso di clonidina, mettere in guardia i pazienti dall'impegnarsi in attività come guidare un veicolo o utilizzare apparecchi o macchinari. Inoltre, informare i pazienti che questo effetto sedativo può essere aumentato dall'uso concomitante di alcol, barbiturici o altri farmaci sedativi.
I pazienti che portano lenti a contatto devono essere avvertiti che il trattamento con CATAPRES compresse può causare secchezza degli occhi.
