Plavix 75mg Clopidogrel Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Plavix 75mg e come si usa?
Plavix 75mg è un medicinale soggetto a prescrizione medica usato per trattare i sintomi della sindrome coronarica acuta come ictus, coaguli di sangue o gravi problemi cardiaci dopo un infarto, un forte dolore toracico o problemi di circolazione. Plavix 75mg può essere usato da solo o con altri farmaci.
Plavix 75mg appartiene a una classe di farmaci chiamati agenti antipiastrinici, cardiovascolari, agenti antipiastrinici, ematologici.
Non è noto se Plavix sia sicuro ed efficace nei bambini.
Quali sono i possibili effetti collaterali di Plavix 75mg?
Plavix 75mg può causare gravi effetti collaterali tra cui:
- pelle pallida,
- lividi facili,
- macchie viola sotto la pelle o in bocca,
- ingiallimento della pelle o degli occhi (ittero),
- battiti cardiaci veloci,
- fiato corto,
- male alla testa,
- febbre,
- debolezza,
- sentirsi stanco,
- minzione scarsa o assente,
- convulsioni (convulsioni),
- improvviso intorpidimento o debolezza,
- confusione, e
- problemi di vista o di parola
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Plavix includono:
- aumento del sanguinamento,
- sangue dal naso,
- mal di testa,
- prurito, e
- lividi
AVVERTIMENTO
EFFETTO ANTIPIASTRINA DIMINUITO NEI PAZIENTI CON DUE ALLELI DI PERDITA DI FUNZIONE DEL GENE CYP2C19
L'efficacia di Plavix 75 mg deriva dalla sua attività antipiastrinica, che dipende dalla sua conversione in un metabolita attivo da parte del sistema del citocromo P450 (CYP), principalmente CYP2C19 [vedi AVVERTENZE E PRECAUZIONI , FARMACOLOGIA CLINICA ]. Plavix alle dosi raccomandate forma meno metabolita attivo e quindi ha un effetto ridotto sull'attività piastrinica nei pazienti omozigoti per gli alleli non funzionali del gene CYP2C19 (denominati “metabolizzatori lenti del CYP2C19”). Sono disponibili test per identificare i pazienti che sono metabolizzatori lenti del CYP2C19 [vedi FARMACOLOGIA CLINICA ]. Considerare l'uso di un altro inibitore piastrinico P2Y12 in pazienti identificati come metabolizzatori lenti del CYP2C19.
DESCRIZIONE
Plavix (clopidogrel bisolfato) è un inibitore della classe tienopiridina dei recettori piastrinici P2Y12 ADP. Chimicamente è metil (+)-(S)-α-(2-clorofenil)-6,7-diidrotieno[3,2-c]piridina-5(4H)-acetato solfato (1:1). La formula empirica del clopidogrel bisolfato è C16H16ClNO2S•H2SO4 e il suo peso molecolare è 419,9. La formula strutturale è la seguente:

Clopidogrel bisolfato è una polvere da bianca a biancastra. È praticamente insolubile in acqua a pH neutro ma liberamente solubile a pH 1. Si dissolve liberamente anche in metanolo, si dissolve con parsimonia in cloruro di metilene ed è praticamente insolubile in etere etilico. Ha una rotazione ottica specifica di circa +56°.
Plavix per somministrazione orale è fornito sotto forma di compresse rivestite con film rosa, rotonde, biconvesse, con impresso, contenenti 97,875 mg di clopidogrel bisolfato, che è l'equivalente molare di 75 mg di clopidogrel base o compresse rivestite con film rosa, oblunghe, con impresso, contenenti 391,5 mg di clopidogrel bisolfato che è l'equivalente molare di 300 mg di clopidogrel base.
Ogni compressa contiene olio di ricino idrogenato, idrossipropilcellulosa, mannitolo, cellulosa microcristallina e polietilenglicole 6000 come ingredienti inattivi. La pellicola di rivestimento rosa contiene ossido ferrico, ipromellosa 2910, lattosio monoidrato, biossido di titanio e triacetina. Le tavolette sono lucidate con cera carnauba.
INDICAZIONI
Sindrome coronarica acuta (SCA)
- Plavix 75 mg è indicato per ridurre il tasso di infarto miocardico (IM) e ictus in pazienti con SCA senza sopraslivellamento ST (angina instabile [UA]/infarto miocardico senza sopraslivellamento ST [NSTEMI]), compresi i pazienti che devono essere gestiti medicamente e quelli che devono essere gestiti con rivascolarizzazione coronarica. Plavix 75 mg deve essere somministrato insieme all'aspirina.
- Plavix è indicato per ridurre il tasso di infarto miocardico e ictus nei pazienti con infarto miocardico acuto con sopraslivellamento del tratto ST (STEMI) che devono essere gestiti con cure mediche. Plavix 75 mg deve essere somministrato insieme all'aspirina.
Infarto miocardico recente, ictus recente o arteriopatia periferica accertata
Nei pazienti con arteriopatia periferica accertata o con una storia di recente infarto del miocardio (IM) o ictus recente, Plavix 75 mg è indicato per ridurre il tasso di infarto miocardico e ictus.
DOSAGGIO E SOMMINISTRAZIONE
Sindrome coronarica acuta
Nei pazienti che necessitano di un effetto antipiastrinico entro poche ore, iniziare Plavix con una singola dose di carico orale da 300 mg e poi continuare con 75 mg una volta al giorno. L'inizio di Plavix 75 mg senza una dose di carico ritarderà l'instaurazione di un effetto antipiastrinico di diversi giorni [vedi FARMACOLOGIA CLINICA e Studi clinici ].
Infarto miocardico recente, ictus recente o arteriopatia periferica accertata
75 mg una volta al giorno per via orale senza una dose di carico [vedere FARMACOLOGIA CLINICA e Studi clinici ].
COME FORNITO
Forme di dosaggio e punti di forza
- Compresse da 75 mg: compresse rivestite con film rosa, rotonde, biconvesse, con impresso “75” su un lato e “1171” sull'altro
- Compresse da 300 mg: compresse rosa, oblunghe, rivestite con film, con impresso “300” su un lato e “1332” sull'altro
Stoccaggio e manipolazione
Plavix (clopidogrel bisolfato) 75 mg le compresse sono disponibili sotto forma di compresse rivestite con film rosa, rotonde, biconvesse, con impresso “75” su un lato e “1171” sull'altro. Le compresse sono fornite come segue:
NDC 63653-1171-6 Bottiglie da 30 NDC 63653-1171-1 Bottiglie da 90 NDC 63653-1171-5 Bottiglie da 500 NDC 63653-1171-3 Blister da 100
Plavix (clopidogrel bisolfato) 300 mg le compresse sono disponibili sotto forma di compresse rivestite con film rosa, oblunghe, con impresso “300” su un lato e “1332” sull'altro. Le compresse sono fornite come segue:
NDC 63653-1332-2 Confezioni a dose unitaria da 30
Conservare a 25°C (77°F); escursioni consentite a 15°C-30°C (59°F-86°F) [vedi Temperatura ambiente controllata USP ].
Distribuito da: Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Revisionato: marzo 2021
EFFETTI COLLATERALI
Le seguenti reazioni avverse gravi sono discusse di seguito e altrove nell'etichettatura:
- Sanguinamento [vedi AVVERTENZE E PRECAUZIONI ]
- Porpora trombotica trombocitopenica [vedi AVVERTENZE E PRECAUZIONI ]
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni e durate di follow-up molto variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
La sicurezza di Plavix è stata valutata in oltre 54.000 pazienti, inclusi oltre 21.000 pazienti trattati per un anno o più. Le reazioni avverse clinicamente importanti osservate negli studi che hanno confrontato Plavix 75 mg più aspirina con placebo più aspirina e gli studi che hanno confrontato Plavix da solo con aspirina da sola sono discussi di seguito.
Sanguinamento
CURA
In CURE, l'uso di Plavix con l'aspirina è stato associato a un aumento delle emorragie maggiori (principalmente gastrointestinali e nei siti di puntura) rispetto al placebo con l'aspirina (vedere Tabella 1). L'incidenza di emorragia intracranica (0,1%) e sanguinamento fatale (0,2%) era la stessa in entrambi i gruppi. Altri eventi emorragici segnalati più frequentemente nel gruppo clopidogrel sono stati epistassi, ematuria e lividi.
L'incidenza complessiva del sanguinamento è descritta nella Tabella 1.
COMMETTERE
Nello studio COMMIT, tassi simili di sanguinamento maggiore sono stati osservati nel gruppo Plavix 75 mg e nel gruppo placebo, entrambi trattati anche con aspirina (vedere Tabella 2).
CAPRIE (Plavix vs Aspirina)
In CAPRIE, l'emorragia gastrointestinale si è verificata a un tasso del 2,0% in coloro che assumevano Plavix 75 mg contro il 2,7% in quelli che assumevano l'aspirina; sanguinamento che ha richiesto il ricovero si è verificato rispettivamente nello 0,7% e nell'1,1%. L'incidenza di emorragia intracranica è stata dello 0,4% per Plavix rispetto allo 0,5% per l'aspirina.
Altri eventi emorragici segnalati più frequentemente nel gruppo Plavix 75 mg sono stati epistassi ed ematoma.
Altri eventi avversi
In CURE e CHARISMA, che hanno confrontato Plavix più aspirina con l'aspirina da sola, non c'era differenza nel tasso di eventi avversi (diversi dal sanguinamento) tra Plavix e placebo.
Nello studio CAPRIE, che ha confrontato Plavix 75 mg con l'aspirina, il prurito è stato riportato più frequentemente in coloro che assumevano Plavix. Non sono state riportate altre differenze nel tasso di eventi avversi (diversi dal sanguinamento).
Esperienza di post marketing
Le seguenti reazioni avverse sono state identificate durante l'uso successivo all'approvazione di Plavix. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni sconosciute, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco.
In pazienti trattati con Plavix sono state riportate emorragie, comprese quelle con esito fatale.
- Patologie del sistema emolinfopoietico: Agranulocitosi, anemia aplastica/pancitopenia, porpora trombotica trombocitopenica (TTP), emofilia acquisita A
- Disordini gastrointestinali: Colite (inclusa colite ulcerosa o linfocitica), pancreatite, stomatite, ulcera gastrica/duodenale, diarrea
- Patologie sistemiche e condizioni del sito di somministrazione: Febbre
- Patologie epatobiliari: Insufficienza epatica acuta, epatite (non infettiva), test di funzionalità epatica anormale
- Disturbi del sistema immunitario: Reazioni di ipersensibilità, reazioni anafilattoidi, malattia da siero, sindrome autoimmune da insulina, che può portare a grave ipoglicemia
- Patologie del sistema muscoloscheletrico, del tessuto connettivo e delle ossa: Mialgia, artralgia, artrite
- Disturbi del sistema nervoso: Disturbi del gusto, cefalea, ageusia
- Disturbi psichiatrici: Confusione, allucinazioni
- Patologie respiratorie, toraciche e mediastiniche: Broncospasmo, polmonite interstiziale, polmonite eosinofila
- Patologie renali e urinarie: Aumento dei livelli di creatinina
- Patologie della cute e del tessuto sottocutaneo: Eruzione maculopapulare, eritematosa o esfoliativa, orticaria, dermatite bollosa, eczema, necrolisi epidermica tossica, sindrome di Stevens-Johnson, pustolosi esantematica acuta generalizzata (AGEP), angioedema, sindrome da ipersensibilità farmaco-indotta, eruzione cutanea da farmaco con eosinofilia e sintomi sistemici (DRESS), eritema multiforme, lichen planus, prurito generalizzato
- Patologie vascolari: Vasculite, ipotensione
INTERAZIONI DI DROGA
Induttori del CYP2C19
Poiché clopidogrel è metabolizzato nel suo metabolita attivo in parte dal CYP2C19, ci si aspetta che l'uso di farmaci che inducono l'attività di questo enzima provochi un aumento dei livelli di farmaco del metabolita attivo di clopidogrel.
La rifampicina induce fortemente il CYP2C19 con conseguente aumento del livello del metabolita attivo clopidogrel e inibizione piastrinica, che in particolare potrebbe potenziare il rischio di sanguinamento. Per precauzione, evitare l'uso concomitante di potenti induttori del CYP2C19 [vedi AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ].
Inibitori del CYP2C19
Clopidogrel è metabolizzato nel suo metabolita attivo in parte dal CYP2C19. L'uso concomitante di farmaci che inibiscono l'attività di questo enzima determina una riduzione delle concentrazioni plasmatiche del metabolita attivo del clopidogrel e una riduzione dell'inibizione piastrinica [vedi AVVERTENZE E PRECAUZIONI ].
Omeprazolo o esomeprazolo
Evitare l'uso concomitante di Plavix 75 mg con omeprazolo o esomeprazolo. Negli studi clinici, è stato dimostrato che l'omeprazolo riduce significativamente l'attività antipiastrinica di Plavix 75 mg quando somministrato in concomitanza o a distanza di 12 ore. Una riduzione simile dell'attività antipiastrinica è stata osservata con esomeprazolo quando somministrato in concomitanza con Plavix. Dexlansoprazolo, lansoprazolo e pantoprazolo hanno avuto un effetto minore sull'attività antipiastrinica di Plavix rispetto a omeprazolo o esomeprazolo [vedi AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ].
oppioidi
Come con altri inibitori orali della P2Y12, la somministrazione concomitante di agonisti oppioidi ritarda e riduce l'assorbimento di clopidogrel, presumibilmente a causa del rallentamento dello svuotamento gastrico, con conseguente ridotta esposizione ai suoi metaboliti [vedi FARMACOLOGIA CLINICA ]. Considerare l'uso di un agente antipiastrinico parenterale nei pazienti con sindrome coronarica acuta che richiedono la co-somministrazione di morfina o altri agonisti degli oppioidi.
Farmaci antinfiammatori non steroidei (FANS)
La somministrazione concomitante di Plavix 75 mg e FANS aumenta il rischio di sanguinamento gastrointestinale.
Warfarin (substrati CYP2C9)
Sebbene la somministrazione di clopidogrel 75 mg al giorno non abbia modificato la farmacocinetica di S-warfarin (un substrato del CYP2C9) o l'INR nei pazienti che ricevono una terapia a lungo termine con warfarin, la somministrazione concomitante di Plavix 75 mg con warfarin aumenta il rischio di sanguinamento a causa degli effetti indipendenti sulla emostasi.
Tuttavia, ad alte concentrazioni in vitro, clopidogrel inibisce il CYP2C9.
SSRI e SNRI
Poiché gli inibitori selettivi della ricaptazione della serotonina (SSRI) e gli inibitori della ricaptazione della serotonina e della noradrenalina (SNRI) influenzano l'attivazione piastrinica, la somministrazione concomitante di SSRI e SNRI con clopidogrel può aumentare il rischio di sanguinamento.
Repaglinide (substrati del CYP2C8)
Il metabolita acil-β-glucuronide di clopidogrel è un forte inibitore del CYP2C8. Plavix 75 mg può aumentare l'esposizione sistemica ai farmaci che vengono eliminati principalmente dal CYP2C8, richiedendo quindi un aggiustamento della dose e un monitoraggio appropriato.
Plavix ha aumentato l'esposizione alla repaglinide da 3,9 volte a 5,1 volte [vedi FARMACOLOGIA CLINICA ]. Evitare l'uso concomitante di repaglinide con Plavix. Se non è possibile evitare l'uso concomitante, iniziare la repaglinide a 0,5 mg prima di ogni pasto e non superare una dose giornaliera totale di 4 mg. Durante l'uso concomitante può essere necessaria una maggiore frequenza del monitoraggio della glicemia.
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Diminuzione dell'attività antipiastrinica nei pazienti con funzione del CYP2C19 alterata
Clopidogrel è un profarmaco. L'inibizione dell'aggregazione piastrinica da parte del clopidogrel si ottiene attraverso un metabolita attivo. Il metabolismo del clopidogrel nel suo metabolita attivo può essere alterato da variazioni genetiche nel CYP2C19 [vedi AVVISO IN SCATOLA ].
Il metabolismo del clopidogrel può anche essere alterato da farmaci che inibiscono il CYP2C19, come l'omeprazolo o l'esomeprazolo. Evitare l'uso concomitante di Plavix con omeprazolo o esomeprazolo perché entrambi riducono significativamente l'attività antipiastrinica di Plavix [vedi INTERAZIONI DI DROGA ].
Rischio generale di sanguinamento
Gli inibitori P2Y12 (Tienopiridine), incluso Plavix, aumentano il rischio di sanguinamento.
Gli inibitori della P2Y12 (Tienopiridine), inibiscono l'aggregazione piastrinica per tutta la vita delle piastrine (7-10 giorni). Poiché l'emivita del metabolita attivo del clopidogrel è breve, può essere possibile ripristinare l'emostasi somministrando piastrine esogene; tuttavia, le trasfusioni di piastrine entro 4 ore dalla dose di carico o 2 ore dalla dose di mantenimento possono essere meno efficaci.
Ci si aspetta che l'uso di farmaci che inducono l'attività del CYP2C19 determini un aumento dei livelli di farmaco del metabolita attivo del clopidogrel e potrebbe potenziare il rischio di sanguinamento. Per precauzione, evitare l'uso concomitante di potenti induttori del CYP2C19 [vedi INTERAZIONI DI DROGA e FARMACOLOGIA CLINICA ].
Interruzione di Plavix
L'interruzione del trattamento con Plavix aumenta il rischio di eventi cardiovascolari. Se Plavix deve essere sospeso temporaneamente (p. es., per il trattamento di emorragie o per un intervento chirurgico con un rischio maggiore di sanguinamento), ricominciare il trattamento il prima possibile. Quando possibile, interrompere la terapia con Plavix per cinque giorni prima di tale intervento chirurgico. Riprendere Plavix 75 mg non appena si raggiunge l'emostasi.
Porpora Trombotica Trombocitopenica (TTP)
Dopo l'uso di Plavix 75 mg, a volte dopo una breve esposizione ( REAZIONI AVVERSE ].
Reattività crociata tra tienopiridine
Ipersensibilità inclusi rash, angioedema o reazione ematologica è stata segnalata in pazienti trattati con Plavix 75 mg, inclusi pazienti con una storia di ipersensibilità o reazione ematologica ad altre tienopiridine [vedere CONTROINDICAZIONI e REAZIONI AVVERSE ].
Informazioni di consulenza per il paziente
Consigliare ai pazienti di leggere l'etichettatura dei pazienti approvata dalla FDA ( Guida ai farmaci ).
Interruzione
Consigliare ai pazienti di non interrompere il trattamento con Plavix senza prima parlarne con l'operatore sanitario che lo ha prescritto [vedi AVVERTENZE E PRECAUZIONI ].
Sanguinamento
Avvisare i pazienti che:
- si ammacca e sanguina più facilmente
- ci vorrà più tempo del solito per fermare l'emorragia
- devono segnalare qualsiasi sanguinamento imprevisto, prolungato o eccessivo, o sangue nelle feci o nelle urine [vedi AVVERTENZE E PRECAUZIONI ]
Porpora Trombotica Trombocitopenica
Istruire i pazienti a rivolgersi immediatamente a un medico se manifestano sintomi di TTP che non possono essere altrimenti spiegati [vedi AVVERTENZE E PRECAUZIONI ].
Procedure invasive
Consigliare ai pazienti di informare medici e dentisti che stanno assumendo Plavix prima di qualsiasi intervento chirurgico o procedura odontoiatrica [vedi AVVERTENZE E PRECAUZIONI ].
Inibitori della pompa protonica
Avvisare i pazienti di non assumere omeprazolo o esomeprazolo durante l'assunzione di Plavix. Dexlansoprazolo, lansoprazolo e pantoprazolo hanno avuto effetti meno pronunciati sull'attività antipiastrinica di Plavix 75 mg rispetto a omeprazolo o esomeprazolo [vedi INTERAZIONI DI DROGA ].
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Non c'è stata evidenza di tumorigenicità quando clopidogrel è stato somministrato per 78 settimane ai topi e 104 settimane ai ratti a dosaggi fino a 77 mg/kg al giorno, che hanno fornito esposizioni plasmatiche >25 volte quella nell'uomo alla dose giornaliera raccomandata di 75 mg.
Clopidogrel non è risultato genotossico in quattro test in vitro (test di Ames, test di riparazione del DNA negli epatociti di ratto, test di mutazione genetica nei fibroblasti di criceto cinese e analisi dei cromosomi in metafase di linfociti umani) e in un test in vivo (test del micronucleo per via orale in topi).
È stato riscontrato che clopidogrel non ha alcun effetto sulla fertilità dei ratti maschi e femmine trattati prima dell'accoppiamento e durante la gestazione a dosi orali fino a 400 mg/kg al giorno (52 volte la dose umana raccomandata su base mg/m²).
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
I dati disponibili dai casi riportati nella letteratura pubblicata e dalla sorveglianza post-marketing con l'uso di clopidogrel in donne in gravidanza non hanno identificato alcun rischio associato al farmaco per gravi difetti alla nascita o aborto spontaneo [vedi Dati ].Ci sono rischi per la donna incinta e il feto associati a infarto del miocardio e ictus [vedi Considerazioni cliniche ]. Nessuna evidenza di fetotossicità è stata osservata quando clopidogrel è stato somministrato a ratti e conigli gravidi durante l'organogenesi a dosi corrispondenti a 65 e 78 volte la dose giornaliera raccomandata nell'uomo [vedi Dati ].
Il rischio di fondo stimato di gravi difetti alla nascita e aborto spontaneo per le popolazioni indicate non è noto. Tutte le gravidanze hanno un rischio di fondo di difetti alla nascita, perdita o altri esiti avversi. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo nelle gravidanze clinicamente riconosciute è rispettivamente del 2% e del 4% e del 15% e del 20%.
Considerazioni cliniche
Rischio materno e/o embrionale/fetale associato alla malattia
L'infarto miocardico e l'ictus sono emergenze mediche. La terapia per la donna incinta non deve essere sospesa a causa di potenziali preoccupazioni riguardo agli effetti del clopidogrel sul feto.
Manodopera o consegna
L'uso di clopidogrel durante il travaglio o il parto aumenterà il rischio di sanguinamento ed emorragia materna. Evitare il blocco neuroassiale durante l'uso di clopidogrel a causa del rischio di ematoma spinale. Quando possibile, interrompere il clopidogrel da 5 a 7 giorni prima del travaglio, del parto o del blocco neuroassiale.
Dati
Dati umani
dati disponibili dai case report pubblicati su due decenni di uso post-marketing non hanno identificato un'associazione con l'uso di clopidogrel in gravidanza e gravi difetti alla nascita, aborto spontaneo o esiti fetali avversi.
Dati sugli animali
Sono stati condotti studi di tossicologia dello sviluppo embrio-fetale in ratti e conigli gravidi con dosi fino a 500 e 300 mg/kg/die, rispettivamente, somministrate durante l'organogenesi. Queste dosi, corrispondenti rispettivamente a 65 e 78 volte la dose giornaliera raccomandata nell'uomo, su base mg/m², non hanno rivelato evidenza di ridotta fertilità o fetotossicità dovute al clopidogrel.
Allattamento
Riepilogo dei rischi
Non ci sono dati sulla presenza di clopidogrel nel latte materno o sugli effetti sulla produzione di latte. Non sono stati osservati effetti avversi sui lattanti allattati al seno con l'uso materno di clopidogrel durante l'allattamento in un piccolo numero di casi post-marketing. Studi sui ratti hanno dimostrato che clopidogrel e/o suoi metaboliti sono presenti nel latte. Quando un farmaco è presente nel latte animale, è probabile che il farmaco sia presente nel latte umano. I benefici per lo sviluppo e la salute dell'allattamento al seno dovrebbero essere presi in considerazione insieme alla necessità clinica della madre di PLAVIX e qualsiasi potenziale effetto avverso sul bambino allattato al seno da PLAVIX 75 mg o da una condizione materna sottostante.
Uso pediatrico
La sicurezza e l'efficacia nelle popolazioni pediatriche non sono state stabilite.
Uno studio randomizzato, controllato con placebo (CLARINET) non ha dimostrato un beneficio clinico di clopidogrel in neonati e bambini con cardiopatia congenita cianotica palliata con uno shunt arterioso sistemico-polmonare. Possibili fattori che hanno contribuito a questo risultato sono stati la dose di clopidogrel, la somministrazione concomitante di aspirina e l'inizio tardivo della terapia dopo la palliazione dello shunt. Non si può escludere che uno studio con un disegno diverso dimostrerebbe un beneficio clinico in questa popolazione di pazienti.
Uso geriatrico
Del numero totale di soggetti negli studi clinici controllati CAPRIE e CURE, circa il 50% dei pazienti trattati con Plavix aveva un'età pari o superiore a 65 anni e il 15% aveva un'età pari o superiore a 75 anni. Nello studio COMMIT, circa il 58% dei pazienti trattati con Plavix 75 mg aveva 60 anni e più, il 26% dei quali aveva 70 anni e più.
Il rischio osservato di eventi emorragici con Plavix 75 mg più aspirina rispetto a placebo più aspirina per categoria di età è riportato rispettivamente nella Tabella 1 e nella Tabella 2 per gli studi CURE e COMMIT [vedere REAZIONI AVVERSE ]. Non è necessario alcun aggiustamento del dosaggio nei pazienti anziani.
Insufficienza renale
L'esperienza è limitata nei pazienti con insufficienza renale grave e moderata [vedi FARMACOLOGIA CLINICA ].
Insufficienza epatica
Non è necessario alcun aggiustamento del dosaggio nei pazienti con insufficienza epatica [vedi FARMACOLOGIA CLINICA ].
OVERDOSE
L'inibizione piastrinica da parte di Plavix è irreversibile e durerà per tutta la vita delle piastrine. Il sovradosaggio dopo la somministrazione di clopidogrel può causare complicazioni emorragiche. Una singola dose orale di clopidogrel a 1500 o 2000 mg/kg era letale per topi e ratti ea 3000 mg/kg per i babbuini. I sintomi di tossicità acuta erano vomito, prostrazione, respirazione difficoltosa ed emorragia gastrointestinale negli animali.
Sulla base della plausibilità biologica, la trasfusione di piastrine può ripristinare la capacità di coagulazione.
CONTROINDICAZIONI
Sanguinamento attivo
Plavix è controindicato nei pazienti con sanguinamento patologico attivo come ulcera peptica o emorragia intracranica.
Ipersensibilità
Plavix 75 mg è controindicato nei pazienti con ipersensibilità (p. es., anafilassi) al clopidogrel oa qualsiasi componente del prodotto [vedere REAZIONI AVVERSE ].
FARMACOLOGIA CLINICA
Meccanismo di azione
Clopidogrel è un inibitore dell'attivazione e dell'aggregazione piastrinica attraverso il legame irreversibile del suo metabolita attivo alla classe P2Y12 dei recettori ADP sulle piastrine.
Farmacodinamica
Clopidogrel deve essere metabolizzato dagli enzimi CYP450 per produrre il metabolita attivo che inibisce l'aggregazione piastrinica. Il metabolita attivo del clopidogrel inibisce selettivamente il legame dell'adenosina difosfato (ADP) al suo recettore piastrinico P2Y12 e la successiva attivazione mediata dall'ADP del complesso glicoproteico GPIIb/IIIa, inibendo così l'aggregazione piastrinica. Questa azione è irreversibile. Di conseguenza, le piastrine esposte al metabolita attivo del clopidogrel sono interessate per il resto della loro vita (da circa 7 a 10 giorni). Anche l'aggregazione piastrinica indotta da agonisti diversi dall'ADP viene inibita bloccando l'amplificazione dell'attivazione piastrinica da parte dell'ADP rilasciato.
L'inibizione dose-dipendente dell'aggregazione piastrinica può essere osservata 2 ore dopo singole dosi orali di Plavix. Dosi ripetute di 75 mg di Plavix al giorno inibiscono l'aggregazione piastrinica indotta da ADP il primo giorno e l'inibizione raggiunge lo stato stazionario tra il giorno 3 e il giorno 7. Allo stato stazionario, il livello medio di inibizione osservato con una dose di 75 mg di Plavix al giorno era tra il 40% e il 60%. L'aggregazione piastrinica e il tempo di sanguinamento tornano gradualmente ai valori basali dopo l'interruzione del trattamento, generalmente in circa 5 giorni.
Pazienti geriatrici
I soggetti anziani (≥75 anni) e giovani sani hanno avuto effetti simili sull'aggregazione piastrinica.
Pazienti con insufficienza renale
Dopo dosi ripetute di 75 mg di Plavix 75 mg al giorno, i pazienti con grave insufficienza renale (clearance della creatinina da 5 a 15 ml/min) e moderata insufficienza renale (clearance della creatinina da 30 a 60 ml/min) hanno mostrato una bassa (25%) inibizione della Aggregazione piastrinica indotta da ADP.
Pazienti con problemi epatici
Dopo dosi ripetute di 75 mg di Plavix al giorno per 10 giorni in pazienti con grave insufficienza epatica, l'inibizione dell'aggregazione piastrinica indotta da ADP è stata simile a quella osservata nei soggetti sani.
Genere
In un piccolo studio che ha confrontato uomini e donne, nelle donne è stata osservata una minore inibizione dell'aggregazione piastrinica indotta da ADP.

Farmacocinetica
Clopidogrel è un profarmaco ed è metabolizzato in un metabolita farmacologicamente attivo e in metaboliti inattivi.
Assorbimento
Dopo dosi orali singole e ripetute di 75 mg al giorno, clopidogrel viene assorbito rapidamente. L'assorbimento è almeno del 50%, sulla base dell'escrezione urinaria dei metaboliti del clopidogrel.
Effetto del cibo
Plavix può essere somministrato con o senza cibo. In uno studio su soggetti maschi sani in cui Plavix 75 mg al giorno è stato somministrato con una colazione standard, l'inibizione media dell'aggregazione piastrinica indotta da ADP è stata ridotta di meno del 9%. Il metabolita attivo AUC0-24 è rimasto invariato in presenza di cibo, mentre si è verificata una diminuzione del 57% della Cmax del metabolita attivo. Risultati simili sono stati osservati quando una dose di carico di Plavix 300 mg è stata somministrata con una colazione ricca di grassi.
Metabolismo
Clopidogrel è ampiamente metabolizzato da due vie metaboliche principali: una mediata dalle esterasi e che porta all'idrolisi in un derivato dell'acido carbossilico inattivo (85% dei metaboliti circolanti) e una mediata da più enzimi del citocromo P450. I citocromi prima ossidano clopidogrel in un metabolita intermedio 2-oxo-clopidogrel. Il successivo metabolismo del metabolita intermedio 2-oxoclopidogrel determina la formazione del metabolita attivo, un tiolo derivato del clopidogrel. Il metabolita attivo è formato principalmente dal CYP2C19 con il contributo di molti altri enzimi CYP, inclusi CYP1A2, CYP2B6 e CYP3A. Il metabolita attivo tiolo si lega rapidamente e irreversibilmente ai recettori piastrinici, inibendo così l'aggregazione piastrinica per tutta la vita delle piastrine.
La Cmax del metabolita attivo è due volte più alta dopo una singola dose di carico di 300 mg di clopidogrel rispetto a dopo quattro giorni di una dose di mantenimento di 75 mg. La Cmax si verifica circa 30-60 minuti dopo la somministrazione. Nell'intervallo di dose da 75 a 300 mg, la farmacocinetica del metabolita attivo si discosta dalla proporzionalità della dose: 4 volte la dose risulta rispettivamente in 2,0 e 2,7 volte la Cmax e l'AUC.
Eliminazione
Dopo una dose orale di clopidogrel marcato con 14C nell'uomo, circa il 50% della radioattività totale è stata escreta nelle urine e circa il 46% nelle feci nei 5 giorni successivi alla somministrazione. Dopo una singola dose orale di 75 mg, clopidogrel ha un'emivita di circa 6 ore. L'emivita del metabolita attivo è di circa 30 minuti.
Interazioni farmacologiche
Effetto di altri farmaci su Plavix
Clopidogrel è metabolizzato nel suo metabolita attivo in parte dal CYP2C19.
Induttori del CYP2C19
L'uso concomitante di potenti induttori del CYP2C19 determina un aumento della concentrazione plasmatica del metabolita attivo del clopidogrel e un aumento dell'inibizione piastrinica.
Rifampicina: la somministrazione concomitante di rifampicina 300 mg due volte al giorno per 7 giorni con una dose di carico di 600 mg di clopidogrel in adulti sani ha aumentato l'AUC e la Cmax medie dei metaboliti tiolici di clopidogrel di 3,8 volte. L'inibizione media dell'aggregazione piastrinica a 4 ore dopo la dose era del 34% più alta in presenza di rifampicina rispetto al clopidogrel somministrato da solo.
Inibitori del CYP2C19
L'uso concomitante di alcuni inibitori di questo enzima determina una riduzione delle concentrazioni plasmatiche del metabolita attivo del clopidogrel e una riduzione dell'inibizione piastrinica.
Inibitori della pompa protonica (PPI)
L'effetto degli inibitori della pompa protonica (PPI) sull'esposizione sistemica al metabolita attivo clopidogrel a seguito di dosi multiple di Plavix 75 mg valutate in studi di interazione farmacologica dedicati è presentato nella Figura 1.
Figura 1: Esposizione al metabolita attivo di clopidogrel a seguito di dosi multiple di Plavix 75 mg da solo o con inibitori della pompa protonica (PPI)
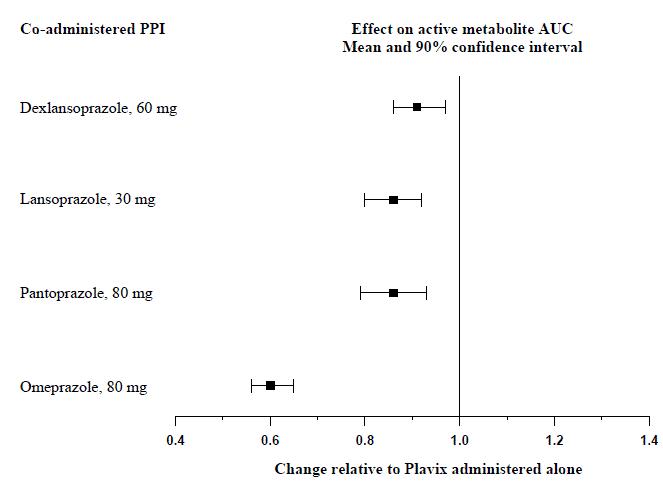
I parametri farmacodinamici e farmacocinetici misurati in questi studi hanno mostrato che l'interazione era massima con omeprazolo e minima con dexlansoprazolo.
oppioidi
La somministrazione concomitante di 5 mg di morfina per via endovenosa con una dose di carico di 600 mg di clopidogrel in adulti sani ha ridotto l'AUC e la Cmax dei metaboliti tiolici di clopidogrel del 34%. L'aggregazione piastrinica media è risultata maggiore fino a 2-4 ore con la somministrazione concomitante di morfina.
Effetto di Plavix 75mg su altri farmaci
Studi in vitro hanno dimostrato che il metabolita glucuronide di clopidogrel è un forte inibitore del CYP2C8. La somministrazione concomitante di repaglinide e Plavix ha aumentato l'esposizione sistemica alla repaglinide (AUC0-∞) di 5,1 volte dopo la dose di carico (300 mg) e di 3,9 volte il giorno 3 della dose di mantenimento (75 mg) di Plavix [vedere INTERAZIONI DI DROGA ].
Farmacogenomica
Il CYP2C19 è coinvolto nella formazione sia del metabolita attivo che del metabolita intermedio 2-oxo-clopidogrel. La farmacocinetica del metabolita attivo del clopidogrel e gli effetti antipiastrinici, misurati mediante saggi di aggregazione piastrinica ex vivo, differiscono in base al genotipo CYP2C19. I pazienti omozigoti per gli alleli non funzionali del gene CYP2C19 sono definiti "metabolizzatori lenti del CYP2C19". Circa il 2% dei pazienti bianchi e il 4% dei neri sono scarsi metabolizzatori; la prevalenza di scarso metabolismo è maggiore nei pazienti asiatici (p. es., 14% dei cinesi). Sono disponibili test per identificare i pazienti che sono metabolizzatori lenti del CYP2C19.
Uno studio crossover su 40 soggetti sani, 10 ciascuno nei quattro gruppi metabolizzatori del CYP2C19, ha valutato le risposte farmacocinetiche e antipiastriniche utilizzando 300 mg seguiti da 75 mg al giorno e 600 mg seguiti da 150 mg al giorno, ciascuno per un totale di 5 giorni. Nei metabolizzatori lenti sono state osservate una ridotta esposizione al metabolita attivo e una ridotta inibizione dell'aggregazione piastrinica rispetto agli altri gruppi.
Studi clinici
Sindrome coronarica acuta
CURA
Lo studio CURE ha incluso 12.562 pazienti con SCA senza sopraslivellamento ST (UA o NSTEMI) e che presentavano entro 24 ore dall'esordio dell'episodio più recente di dolore toracico o sintomi compatibili con ischemia. I pazienti dovevano presentare variazioni dell'ECG compatibili con una nuova ischemia (senza sopraslivellamento del tratto ST) o livelli elevati di enzimi cardiaci o troponina I o T ad almeno il doppio del limite superiore della norma.
pazienti sono stati randomizzati a ricevere Plavix (dose di carico di 300 mg seguita da 75 mg una volta al giorno) o placebo e sono stati trattati per un massimo di un anno. I pazienti hanno anche ricevuto aspirina (75-325 mg una volta al giorno) e altre terapie standard come l'eparina. L'uso di inibitori della GPIIb/IIIa non è stato consentito nei tre giorni precedenti la randomizzazione.
La popolazione dei pazienti era in gran parte bianca (82%) e comprendeva il 38% di donne e il 52% di età ≥65 anni. Solo il 20% circa dei pazienti è stato sottoposto a rivascolarizzazione durante il ricovero iniziale e pochi sono stati sottoposti a rivascolarizzazione d'emergenza o d'urgenza.
Il numero di pazienti che hanno manifestato l'esito primario (morte CV, infarto miocardico o ictus) è stato 582 (9,3%) nel gruppo trattato con Plavix e 719 (11,4%) nel gruppo trattato con placebo, una riduzione del rischio relativo del 20% (95 % CI del 10%-28%; p
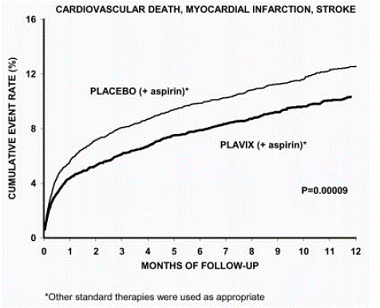
La maggior parte dei benefici di Plavix si è verificata nei primi due mesi, ma la differenza rispetto al placebo è stata mantenuta per tutto il corso dello studio (fino a 12 mesi) (vedere la Figura 2).
Figura 2: Morte cardiovascolare, infarto del miocardio e ictus nello studio CURE
L'effetto di Plavix 75 mg non differiva significativamente nei vari sottogruppi, come mostrato nella Figura 3. I benefici associati a Plavix 75 mg erano indipendenti dall'uso di altre terapie cardiovascolari acute ea lungo termine, tra cui eparina/EBPM, glicoproteina IIb/IIIa per via endovenosa (GPIIb/IIIa), farmaci ipolipemizzanti, beta-bloccanti e ACE-inibitori. L'efficacia di Plavix è stata osservata indipendentemente dalla dose di aspirina (75-325 mg una volta al giorno). L'uso di anticoagulanti orali, farmaci antipiastrinici non in studio e FANS cronici non era consentito in CURE.
Figura 3: Rapporto di rischio per le caratteristiche basali del paziente e i farmaci/interventi concomitanti durante lo studio per lo studio CURE
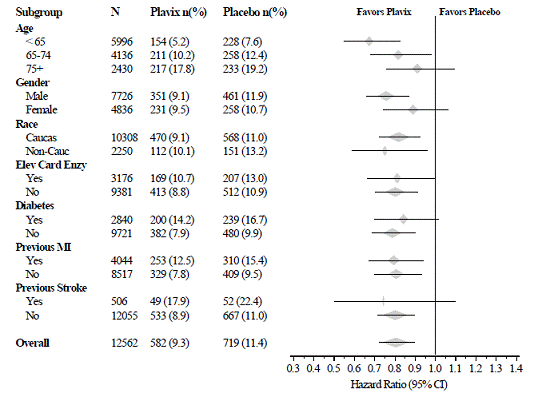
Figura 3: Rapporto di rischio per le caratteristiche basali del paziente e i farmaci/interventi concomitanti durante lo studio per lo studio CURE (continua)
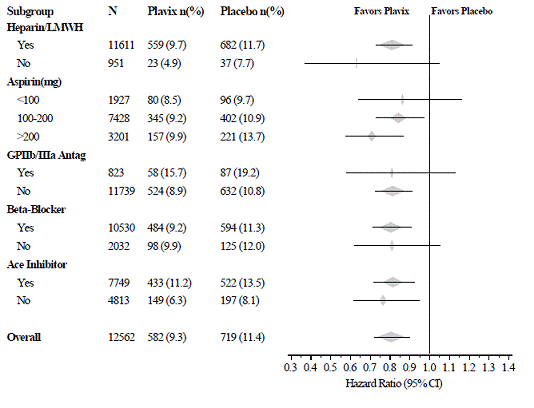
L'uso di Plavix in CURE è stato associato a una diminuzione dell'uso della terapia trombolitica (71 pazienti [1,1%] nel gruppo Plavix 75 mg, 126 pazienti [2,0%] nel gruppo placebo; riduzione del rischio relativo del 43%) e Inibitori della GPIIb/IIIa (369 pazienti [5,9%] nel gruppo Plavix 75 mg, 454 pazienti [7,2%] nel gruppo placebo, riduzione del rischio relativo del 18%). L'uso di Plavix 75 mg in CURE non ha influenzato il numero di pazienti trattati con CABG o PCI (con o senza stent) (2253 pazienti [36,0%] nel gruppo Plavix 75 mg, 2324 pazienti [36,9%] nel gruppo placebo; parente riduzione del rischio del 4,0%).
COMMETTERE
Nei pazienti con STEMI, la sicurezza e l'efficacia di Plavix sono state valutate nello studio randomizzato, controllato con placebo, in doppio cieco, COMMIT. COMMIT ha incluso 45.852 pazienti che si presentavano entro 24 ore dall'esordio dei sintomi di infarto miocardico con anomalie dell'ECG di supporto (es. sopraslivellamento del tratto ST, depressione del tratto ST o blocco di branca sinistra). I pazienti sono stati randomizzati a ricevere Plavix (75 mg una volta al giorno) o placebo, in combinazione con aspirina (162 mg al giorno), per 28 giorni o fino alla dimissione dall'ospedale, a seconda di quale evento si verificasse prima.
Gli endpoint primari erano la morte per qualsiasi causa e la prima insorgenza di re-infarto, ictus o morte.
La popolazione dei pazienti era composta per il 28% da donne e per il 58% con età ≥60 anni (26% con età ≥70 anni). Il 55% (55%) dei pazienti ha ricevuto trombolitici e solo il 3% è stato sottoposto a PCI.
Come mostrato nella Tabella 5 e nella Figura 4 e nella Figura 5 di seguito, Plavix ha ridotto significativamente il rischio relativo di morte per qualsiasi causa del 7% (p=0,029) e il rischio relativo della combinazione di reinfarto, ictus o morte del 9% ( p=0,002).
Figura 4: Tassi cumulativi di eventi di morte nello studio COMMIT*
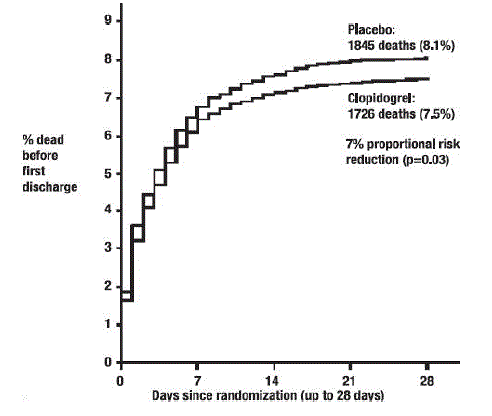
Figura 5: Tassi cumulativi di eventi per il re-infarto, ictus o morte dell'endpoint combinato nello studio COMMIT*
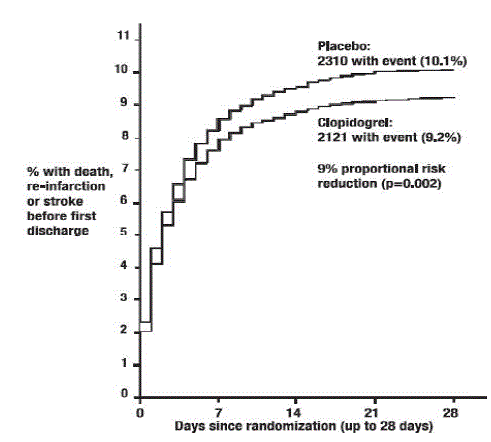
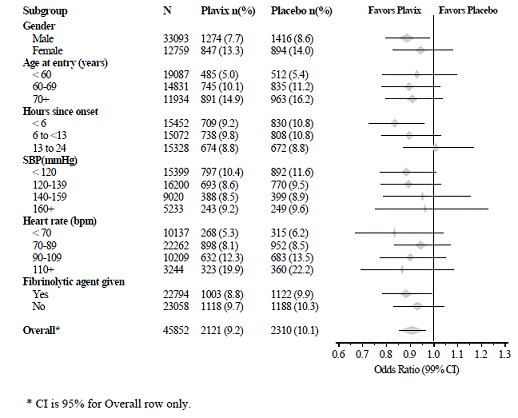
L'effetto di Plavix 75 mg non differiva significativamente nei vari sottogruppi prespecificati, come mostrato nella Figura 6. L'effetto era simile anche nei sottogruppi non prespecificati, inclusi quelli basati sulla localizzazione dell'infarto, sulla classe Killip o sulla precedente storia di infarto miocardico. Tali analisi di sottogruppi dovrebbero essere interpretate con cautela.
Figura 6: Effetti dell'aggiunta di Plavix 75 mg all'aspirina sull'endpoint primario combinato nei sottogruppi di farmaci di base e concomitanti per lo studio COMMIT
Infarto miocardico recente, ictus recente o arteriopatia periferica accertata
CAPRIE
Lo studio CAPRIE è stato uno studio internazionale, randomizzato, in doppio cieco, a gruppi paralleli su 19.185 pazienti, 304 centri, che ha confrontato Plavix (75 mg al giorno) con l'aspirina (325 mg al giorno). Per essere ammessi all'arruolamento, i pazienti dovevano avere: 1) storia recente di infarto del miocardio (entro 35 giorni); 2) storie recenti di ictus ischemico (entro 6 mesi) con almeno una settimana di segni neurologici residui; e/o 3) malattia arteriosa periferica (PAD) accertata. I pazienti hanno ricevuto un trattamento randomizzato per una media di 1,6 anni (massimo 3 anni).
L'esito primario dello studio era il tempo alla prima insorgenza di un nuovo ictus ischemico (fatale o meno), un nuovo infarto del miocardio (fatale o meno) o altra morte vascolare. I decessi non facilmente attribuibili a cause non vascolari sono stati tutti classificati come vascolari.
Come mostrato nella Tabella 6, Plavix era associato a una minore incidenza di eventi di esito, principalmente infarto del miocardio. La riduzione complessiva del rischio relativo (9,8% vs 10,6%) è stata dell'8,7%, p=0,045. Risultati simili sono stati ottenuti quando sono stati contati la mortalità per tutte le cause e gli ictus per tutte le cause invece della mortalità vascolare e degli ictus ischemici (riduzione del rischio 6,9%). Nei pazienti sopravvissuti a un ictus oa un infarto del miocardio durante lo studio, l'incidenza di eventi successivi è stata inferiore nel gruppo Plavix 75 mg.
Le curve che mostrano il tasso complessivo di eventi sono mostrate nella Figura 7. Le curve degli eventi si sono separate precocemente e hanno continuato a divergere nel periodo di follow-up di 3 anni.
Figura 7: Eventi vascolari fatali o non fatali nello studio CAPRIE
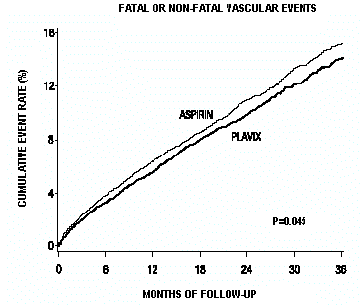
La significatività statistica a favore di Plavix 75 mg rispetto all'aspirina era marginale (p=0,045). Tuttavia, poiché l'aspirina è di per sé efficace nel ridurre gli eventi cardiovascolari nei pazienti con infarto miocardico recente o ictus, l'effetto di Plavix 75 mg è sostanziale.
Lo studio CAPRIE ha arruolato una popolazione con infarto miocardico recente, ictus recente o PAD. L'efficacia di Plavix 75 mg rispetto all'aspirina era eterogenea in questi sottogruppi (p=0,043) (vedi Figura 8). Tuttavia, questa differenza può essere un evento casuale perché lo studio CAPRIE non è stato progettato per valutare il beneficio relativo di Plavix 75 mg rispetto all'aspirina nei singoli sottogruppi di pazienti. Il beneficio è stato più evidente nei pazienti arruolati a causa della malattia arteriosa periferica e meno evidente nei pazienti con ictus. Nei pazienti che sono stati arruolati nello studio sulla sola base di un recente infarto del miocardio, Plavix 75 mg non è risultato numericamente superiore all'aspirina.
Figura 8: Rapporto di rischio e IC al 95% per sottogruppi di riferimento nello studio CAPRIE
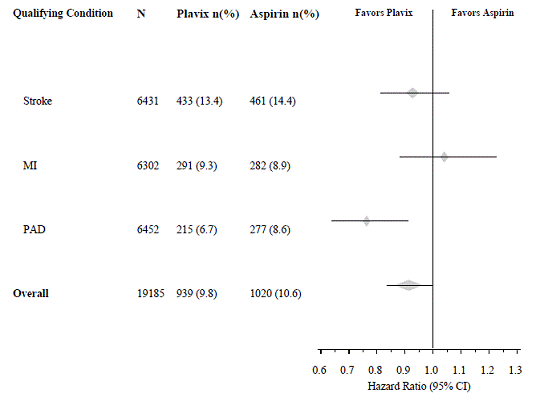
Nessun beneficio dimostrato di Plavix 75 mg più aspirina in pazienti con molteplici fattori di rischio o malattia vascolare accertata
CARISMA
Lo studio CHARISMA è stato uno studio su 15.603 soggetti, randomizzato, in doppio cieco, a gruppi paralleli che ha confrontato Plavix (75 mg al giorno) con placebo per la prevenzione di eventi ischemici in pazienti con malattie vascolari o fattori di rischio multipli per l'aterosclerosi. Tutti i soggetti sono stati trattati con aspirina 75-162 mg al giorno. La durata media del trattamento è stata di 23 mesi. Lo studio non è riuscito a dimostrare una riduzione nell'occorrenza dell'endpoint primario, un composito di morte CV, infarto del miocardio o ictus. Un totale di 534 (6,9%) pazienti nel gruppo Plavix rispetto a 573 (7,4%) pazienti nel gruppo placebo hanno avuto un evento di esito primario (p=0,22). Il sanguinamento di tutte le severità era più comune nei soggetti randomizzati a Plavix.
INFORMAZIONI PER IL PAZIENTE
Plavix® (PLAV-iks) (clopidogrel bisolfato) compresse
Leggi questa Guida ai farmaci prima di iniziare a prendere Plavix e ogni volta che ricevi una ricarica. Potrebbero esserci nuove informazioni. Questa guida ai farmaci non sostituisce il colloquio con il medico in merito alle proprie condizioni mediche o al trattamento.
Qual è l'informazione più importante che dovrei sapere su Plavix 75mg?
1. Plavix potrebbe non funzionare altrettanto bene nelle persone che:
- hanno alcuni fattori genetici che influenzano il modo in cui il corpo scompone Plavix. Il medico potrebbe eseguire test genetici per assicurarsi che Plavix sia adatto a te.
- assumere determinati medicinali, in particolare omeprazolo (Prilosec®) o esomeprazolo (Nexium®). Il medico può cambiare il medicinale che assume per i problemi di acidità di stomaco mentre prende Plavix.
2. Plavix 75 mg può causare emorragie che possono essere gravi e talvolta portare alla morte. Plavix è un medicinale anticoagulante che riduce la possibilità che si formino coaguli di sangue nel corpo. Mentre prendi Plavix:
- potresti ammaccarti e sanguinare più facilmente
- è più probabile che tu abbia sangue dal naso
- ci vorrà più tempo prima che l'emorragia si fermi
Chiama subito il medico se hai uno qualsiasi di questi segni o sintomi di sanguinamento:
- sanguinamento inaspettato o sanguinamento che dura a lungo
- sangue nelle urine (urina rosa, rossa o marrone)
- feci rosse o nere (sembra catrame)
- lividi che si verificano senza una causa nota o che diventano più grandi
- tossire sangue o coaguli di sangue
- vomiti sangue o il tuo vomito sembra fondi di caffè
Non interrompa l'assunzione di Plavix 75 mg senza aver parlato con il medico che te lo ha prescritto. Le persone che interrompono l'assunzione di Plavix 75 mg troppo presto hanno un rischio maggiore di avere un infarto o di morire. Se deve interrompere Plavix a causa di un'emorragia, il rischio di un attacco cardiaco potrebbe essere maggiore.
Che cos'è Plavix 75mg?
Plavix è un medicinale su prescrizione usato per il trattamento di persone che hanno uno dei seguenti:
- dolore al petto dovuto a problemi cardiaci
- cattiva circolazione nelle gambe (malattia arteriosa periferica)
- un infarto
- un infarto
Plavix viene usato da solo o con l'aspirina per ridurre le possibilità di avere un altro grave problema al cuore o ai vasi sanguigni come infarto, ictus o coaguli di sangue che possono portare alla morte.
Le piastrine sono cellule del sangue che aiutano la coagulazione del sangue normalmente. Plavix 75mg aiuta a prevenire l'adesione delle piastrine e la formazione di un coagulo che può bloccare un'arteria.
Non è noto se Plavix 75 mg sia sicuro ed efficace nei bambini.
Chi non dovrebbe assumere Plavix 75 mg?
Non prenda Plavix se:
- attualmente hanno una condizione che causa sanguinamento, come un'ulcera allo stomaco
- sono allergici al clopidogrel o ad altri componenti di Plavix. Vedere la fine di questo foglio illustrativo per un elenco completo degli ingredienti in Plavix.
Cosa devo dire al mio medico prima di prendere Plavix 75 mg?
Prima di prendere Plavix, informi il medico se:
- ha una storia di ulcere intestinali (gastrointestinali) o allo stomaco
- ha una storia di problemi di sanguinamento
- pianificare un intervento chirurgico o una procedura dentale. Vedere "Come dovrei prendere Plavix?"
- sono incinta o stanno pianificando una gravidanza. Non è noto se Plavix 75mg danneggerà il feto
- stanno allattando o pianificano di allattare. Non è noto se Plavix 75 mg passi nel latte materno. Deve essere presa una decisione con il medico per evitare o interrompere l'allattamento al seno quando è necessario continuare Plavix.
- ha avuto un'allergia o una reazione a qualsiasi medicinale usato per curare la sua malattia.
Dica a tutti i suoi medici e al suo dentista che sta assumendo Plavix. Dovrebbero parlare con il medico che le ha prescritto Plavix 75 mg prima di sottoporsi a qualsiasi intervento chirurgico o procedura invasiva.
Informa il tuo medico di tutti i medicinali che prendi, compresi farmaci da prescrizione, senza prescrizione medica, vitamine e integratori a base di erbe.
Plavix 75 mg può influire sul modo in cui agiscono altri medicinali e altri medicinali possono influire sul modo in cui agisce Plavix. Vedere "Qual è l'informazione più importante che dovrei sapere su Plavix 75mg?"
Plavix 75 mg può aumentare i livelli ematici di altri medicinali come la repaglinide (Prandin®).
L'assunzione di Plavix con alcuni altri medicinali può aumentare il rischio di sanguinamento.
In particolare informi il medico se assume:
- aspirina, soprattutto se hai avuto un ictus. Parla sempre con il tuo medico se dovresti prendere l'aspirina insieme a Plavix 75 mg per trattare la tua condizione.
- Farmaci antinfiammatori non steroidei (FANS). Chieda al medico o al farmacista un elenco di farmaci FANS se ha dei dubbi.
- warfarin (Coumadin®, Jantoven®).
- inibitori selettivi della ricaptazione della serotonina (SSRI) e inibitori della ricaptazione della serotonina e della noradrenalina (SNRI). Chieda al medico o al farmacista un elenco di medicinali SSRI o SNRI se ha dei dubbi.
- rifampicina (usata per il trattamento di infezioni gravi)
Conosci le medicine che prendi. Tienine un elenco da mostrare al medico o al farmacista quando prendi un nuovo medicinale.
Come devo prendere Plavix?
- Prenda Plavix esattamente come le ha detto il medico.
- Non modifichi la dose né interrompa l'assunzione di Plavix 75 mg senza prima aver consultato il medico. L'interruzione di Plavix può aumentare il rischio di infarto o ictus.
- Assumere Plavix 75 mg con l'aspirina secondo le istruzioni del medico.
- Se dimentica una dose, prenda Plavix non appena se ne ricorda. Se è quasi ora di prendere la dose successiva, salti la dose dimenticata. Prenda la dose successiva all'orario abituale. Non prenda 2 dosi di Plavix 75 mg contemporaneamente a meno che non glielo dica il medico.
- Se prende troppo Plavix, chiami il medico o si rechi immediatamente al pronto soccorso più vicino.
- Parla con il tuo medico per interrompere il tuo Plavix 75 mg prima di un intervento chirurgico. Il medico potrebbe dirti di interrompere l'assunzione di Plavix 75 mg almeno 5 giorni prima dell'intervento chirurgico per evitare un'emorragia eccessiva durante l'intervento chirurgico.
Quali sono i possibili effetti collaterali di Plavix?
Plavix 75mg può causare gravi effetti collaterali tra cui:
- Vedi "Qual è l'informazione più importante che dovrei sapere su Plavix?"
- Un problema di coagulazione del sangue chiamato porpora trombotica trombocitopenica (TTP). Il TTP può verificarsi con Plavix 75 mg, a volte dopo un breve periodo (meno di 2 settimane). La TTP è un problema di coagulazione del sangue in cui si formano coaguli di sangue nei vasi sanguigni; e può accadere in qualsiasi parte del corpo. La TTP deve essere curata immediatamente in ospedale, perché potrebbe causare la morte. Chiedi immediatamente assistenza medica se hai uno qualsiasi di questi sintomi e non possono essere spiegati da un'altra condizione medica:
- macchie violacee (chiamate porpora) sulla pelle o nella bocca (membrane mucose) dovute a sanguinamento sottocutaneo
- la tua pelle o il bianco dei tuoi occhi sono gialli (ittero)
- ti senti stanco o debole
- la tua pelle sembra molto pallida
- febbre
- battito cardiaco accelerato o sensazione di mancanza di respiro
- male alla testa
- il discorso cambia
- confusione
- coma
- ictus
- crisi
- bassa quantità di urina o urina rosa o contenente sangue
- dolore alla zona dello stomaco (addominale).
- nausea, vomito o diarrea
- cambia la vista
- sintomi persistenti di ipoglicemia
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare. Informi il medico se sviluppa una reazione allergica comprese reazioni cutanee durante l'assunzione di Plavix.
Questi non sono tutti i possibili effetti collaterali di Plavix. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
Come devo conservare Plavix 75mg?
- Conservare Plavix 75 mg a una temperatura compresa tra 15°C e 30°C (da 59°F a 86°F).
Tenere Plavix e tutti i medicinali fuori dalla portata dei bambini.
Informazioni generali su Plavix
Talvolta i medicinali vengono utilizzati per scopi diversi da quelli elencati in una Guida ai farmaci. Non prenda Plavix 75 mg per una condizione per la quale non è stato prescritto. Non somministrare Plavix ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Questa Guida ai farmaci riassume le informazioni più importanti su Plavix. Se desideri maggiori informazioni, parli con il medico. Chieda al medico o al farmacista informazioni su Plavix che è stato scritto per gli operatori sanitari.
Per ulteriori informazioni, visitare www.sanofi-aventis.us o www.bms.com o chiamare il numero 1-800-321-1335.
Quali sono gli ingredienti di Plavix 75mg?
Principio attivo: clopidogrel bisolfato
Ingredienti inattivi:
Compressa: olio di ricino idrogenato, idrossipropilcellulosa, mannitolo, cellulosa microcristallina, polietilenglicole 6000
Film di rivestimento: ossido ferrico, ipromellosa 2910, lattosio monoidrato, biossido di titanio, triacetina, cera carnauba
Questa guida ai farmaci è stata approvata dalla Food and Drug statunitense.
