Nimotop 30mg Nimodipine Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Nimotop 30mg e come si usa?
Nimotop è un medicinale da prescrizione usato per trattare i sintomi dell'aneurisma (emorragia subaracnoidea). Nimotop può essere usato da solo o con altri farmaci.
Nimotop appartiene a una classe di farmaci chiamati Calcio Channel Blockers; Neurologia, Altro; Calcio-antagonisti, diidrofiridina.
Non è noto se Nimotop 30mg sia sicuro ed efficace nei bambini.
Quali sono i possibili effetti collaterali di Nimotop?
Nimotop può causare gravi effetti collaterali tra cui:
- orticaria,
- respirazione difficoltosa,
- gonfiore del viso, delle labbra, della lingua o della gola,
- stordimento,
- frequenza cardiaca veloce o lenta e
- gonfiore o caviglie o piedi
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Nimotop includono:
- bassa pressione sanguigna (sensazione di stordimento),
- nausea,
- mal di stomaco,
- battiti cardiaci lenti, e
- dolore muscolare
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Nimotop. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
NON SOMMINISTRARE NIMOTOP (nimodipina) PER VIA ENDOVENOSA O PER ALTRE VIE PARENTERALI. MORTI ED EVENTI AVVERSI GRAVI E MINORI DI VITA SI SONO VERIFICATI QUANDO I CONTENUTI DELLE CAPSULE DI NIMOTOP (nimodipina) SONO STATI INIETTATI PARENTERALMENTE (Vedi AVVERTENZE e DOSAGGIO E SOMMINISTRAZIONE).
DESCRIZIONE
Nimotop® (nimodipina) appartiene alla classe degli agenti farmacologici noti come calcio-antagonisti. La nimodipina è isopropile 2 - metossietile 1, 4 - diidro - 2, 6 - dimetil - 4 - (m-nitrofenil) - 3, 5 - piridinedicarbossilato. Ha un peso molecolare di 418,5 e una formula molecolare di C21H26N2O7. La formula strutturale è:
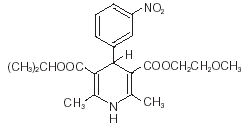
La nimodipina è una sostanza cristallina gialla, praticamente insolubile in acqua.
Le capsule di NIMOTOP® (nimodipina) sono formulate come capsule di gelatina molle per somministrazione orale. Ogni capsula riempita di liquido contiene 30 mg di nimodipina in un veicolo di glicerina, olio di menta piperita, acqua purificata e polietilenglicole 400. L'involucro della capsula in gelatina morbida contiene gelatina, glicerina, acqua purificata e biossido di titanio.
INDICAZIONI
Nimotop® (nimodipina) è indicato per il miglioramento dell'outcome neurologico riducendo l'incidenza e la gravità dei deficit ischemici nei pazienti con emorragia subaracnoidea da rottura di aneurismi intracranici della bacca indipendentemente dalla loro condizione neurologica post-ictus (cioè, Hunt e Hess Grado IV).
DOSAGGIO E SOMMINISTRAZIONE
NON SOMMINISTRARE LE CAPSULE DI NIMOTOP (nimodipina) PER VIA ENDOVENOSA O PER ALTRE VIE PARENTERALI (vedi AVVERTENZE). Se Nimotop (nimodipina) viene somministrato inavvertitamente per via endovenosa, un'ipotensione clinicamente significativa può richiedere un supporto cardiovascolare con agenti pressori. Devono essere somministrati tempestivamente anche trattamenti specifici per il sovradosaggio di calcioantagonisti.
Nimotop (nimodipina) viene somministrato per via orale sotto forma di capsule di gelatina molle color avorio da 30 mg per l'emorragia subaracnoidea.
La dose orale è di 60 mg (due capsule da 30 mg) ogni 4 ore per 21 giorni consecutivi, preferibilmente non meno di un'ora prima o due ore dopo i pasti. La terapia orale con Nimotop® (nimodipina) deve iniziare entro 96 ore dall'emorragia subaracnoidea.
Se la capsula non può essere ingerita, ad es. al momento dell'intervento chirurgico, o se il paziente è privo di sensi, praticare un foro in entrambe le estremità della capsula con un ago calibro 18 e il contenuto della capsula deve essere estratto in una siringa. Una siringa parenterale può essere utilizzata per estrarre il liquido all'interno della capsula, ma il liquido deve sempre essere trasferito in una siringa che non può accettare un ago e che è progettata per la somministrazione per via orale o tramite sondino nasogastrico o PEG. Per ridurre al minimo gli errori di somministrazione, si raccomanda che la siringa utilizzata per la somministrazione sia etichettata come "Non per uso endovenoso". Il contenuto deve quindi essere svuotato nel tubo situnaso-gastrico del paziente e lavato nel tubo con 30 ml di soluzione fisiologica normale (0,9%). L'efficacia e la sicurezza di questo metodo di somministrazione non sono state dimostrate negli studi clinici.
pazienti con cirrosi epatica hanno una clearance sostanzialmente ridotta e una Cmax approssimativamente raddoppiata. Il dosaggio deve essere ridotto a 30 mg ogni 4 ore, con un attento monitoraggio della pressione sanguigna e della frequenza cardiaca.
COME FORNITO
Ogni capsula di NIMOTOP® (nimodipina) in gelatina morbida color avorio è stampata con la parola Nimotop 30 mg e contiene 30 mg di nimodipina. Le capsule da 30 mg sono confezionate in buste di alluminio per dose unitaria e fornite in scatole contenenti 100 capsule. Il prodotto è disponibile anche in buste di alluminio di sicurezza a dose unitaria a prova di bambino contenenti 30 capsule per cartone. Le capsule devono essere conservate nella confezione originale del produttore a 25°C (77°F), escursioni consentite a 15-30°C (59-86°F) [Vedere la temperatura ambiente controllata dall'USP.]
Le capsule devono essere protette dalla luce e dal gelo.
Distribuito da: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Prodotto da: Catalent Pharma Solutions St. Petersburg, FL 33716. Data di revisione FDA: 20/01/2006
EFFETTI COLLATERALI
Esperienze avverse sono state riportate da 92 su 823 pazienti con emorragia subaracnoidea (11,2%) a cui è stata somministrata nimodipina. L'esperienza avversa riportata più frequentemente è stata la diminuzione della pressione sanguigna nel 4,4% di questi pazienti. Ventinove dei 479 (6,1%) pazienti trattati con placebo hanno riportato anche esperienze avverse. Gli eventi riportati con una frequenza superiore all'1% sono riportati di seguito per dose.
DOSE q4h Numero di pazienti (%) Nimodipina
Non sono state segnalate altre esperienze avverse dai pazienti a cui sono stati somministrati 0,35 mg/kg ogni 4 ore, 30 mg ogni 4 ore o 120 mg ogni 4 ore. Le esperienze avverse con un tasso di incidenza inferiore all'1% nel gruppo trattato con la dose di 60 mg ogni 4 ore sono state: epatite; prurito; emorragia gastrointestinale; trombocitopenia; anemia; palpitazioni; vomito; risciacquo; diaforesi; respiro sibilante; tossicità da fenitoina; vertigini; vertigini; vasospasmo di rimbalzo; ittero; ipertensione; ematoma.
Le esperienze avverse con un tasso di incidenza inferiore all'1% nel gruppo trattato con la dose di 90 mg ogni 4 ore sono state: prurito, emorragia gastrointestinale; trombocitopenia; deterioramento neurologico; vomito; diaforesi; insufficienza cardiaca congestizia; iponatriemia; diminuzione della conta piastrinica; coagulazione intravascolare disseminata; trombosi venosa profonda.
Come si può vedere dalla tabella, gli effetti collaterali che sembrano correlati all'uso di nimodipina in base all'aumentata incidenza con dosi più elevate o un tasso più elevato rispetto al controllo con placebo, includevano diminuzione della pressione sanguigna, edema e cefalea che sono azioni farmacologiche note dei calcioantagonisti. Va notato, tuttavia, che la SAH è spesso accompagnata da alterazioni della coscienza che portano a una sottostima delle esperienze avverse. I pazienti che hanno ricevuto nimodipina negli studi clinici per altre indicazioni hanno riportato vampate di calore (2,1%), cefalea (4,1%) e ritenzione di liquidi (0,3%), risposte tipiche ai calcioantagonisti. In quanto calcio-antagonista, la nimodipina può potenzialmente esacerbare l'insufficienza cardiaca in pazienti predisposti o interferire con la conduzione AV, ma questi eventi non sono stati osservati.
Nessun effetto clinicamente significativo sui fattori ematologici, sulla funzionalità renale o epatica o sul metabolismo dei carboidrati è stato causalmente associato alla nimodipina orale. Sono stati segnalati casi isolati di livelli sierici elevati di glucosio (0,8%), livelli elevati di LDH (0,4%), conta piastrinica ridotta (0,3%), livelli elevati di fosfatasi alcalina (0,2%) e livelli elevati di SGPT (0,2%) raramente.

Abuso di droghe e dipendenza
Non sono stati segnalati casi di abuso di droghe o dipendenza da Nimotop® (nimodipina) .
INTERAZIONI DI DROGA
È possibile che l'azione cardiovascolare di altri calcio-antagonisti possa essere potenziata dall'aggiunta di Nimotop® (nimodipina) .
In Europa, è stato osservato che Nimotop® (nimodipina) intensifica occasionalmente l'effetto dei composti antipertensivi assunti in concomitanza da pazienti affetti da ipertensione; questo fenomeno non è stato osservato negli studi clinici nordamericani.
Uno studio su otto volontari sani ha mostrato un aumento del 50% delle concentrazioni plasmatiche di picco medie di nimodipina e un aumento del 90% dell'area media sotto la curva, dopo un ciclo di una settimana di cimetidina a 1.000 mg/die e nimodipina a 90 mg/die . Questo effetto può essere mediato dalla nota inibizione del citocromo P-450 epatico da parte della cimetidina, che potrebbe diminuire il metabolismo di primo passaggio della nimodipina.
AVVERTENZE
MORTE DOVUTO A SOMMINISTRAZIONE ENDOVENA INVOLTA: NON SOMMINISTRARE NIMOTOP (nimodipina) PER VIA ENDOVENOSA O PER ALTRE VIE PARENTERALI. MORTI ED EVENTI AVVERSI GRAVI E CHE MINACCIANO LA VITA, COMPRESI ARRESTO CARDIACO, COLLASSO CARDIOVASCOLARE, IPOTENSIONE E BRADICARDIA, SI SONO VERIFICATI QUANDO LE CAPSULE DI NIMOTOP (nimodipina) SONO STATE INIETTATE PARENTERALMENTE (VEDI DOSAGGIO E SOMMINISTRAZIONE).
PRECAUZIONI
Generale: Pressione sanguigna: la nimodipina ha gli effetti emodinamici attesi da un calcio-antagonista, sebbene generalmente non siano marcati. Tuttavia, la somministrazione endovenosa del contenuto di Nimotop (nimodipina) Capsule ha provocato gravi conseguenze avverse tra cui morte, arresto cardiaco, collasso cardiovascolare, ipotensione e bradicardia. Nei pazienti con emorragia subaracnoidea trattati con Nimotop® (nimodipina) negli studi clinici, è stato riferito che circa il 5% ha avuto un abbassamento della pressione sanguigna e circa l'1% ha abbandonato lo studio per questo motivo (non tutto può essere attribuito alla nimodipina). Tuttavia, la pressione sanguigna deve essere attentamente monitorata durante il trattamento con Nimotop® (nimodipina) sulla base della sua farmacologia nota e degli effetti noti dei calcioantagonisti. (vedere AVVERTENZE e DOSAGGIO E SOMMINISTRAZIONE )
Malattia epatica: il metabolismo di Nimotop® (nimodipina) è ridotto nei pazienti con funzionalità epatica compromessa. Tali pazienti devono monitorare attentamente la pressione sanguigna e la frequenza cardiaca e somministrare una dose più bassa (vedere paragrafo 4.5). DOSAGGIO E SOMMINISTRAZIONE ).
Pseudo-ostruzione intestinale e ileo sono stati riportati raramente in pazienti trattati con nimodipina. Non è stata stabilita una relazione causale. La condizione ha risposto alla gestione conservativa.
Interazioni test di laboratorio: Nessuno noto.
Cancerogenesi, mutagenesi, compromissione della fertilità: In uno studio di due anni, sono state osservate incidenze maggiori di adenocarcinoma dell'utero e adenoma a cellule di Leydig dei testicoli nei ratti trattati con una dieta contenente 1800 ppm di nimodipina (equivalenti a 91-121 mg/kg/die di nimodipina) rispetto ai controlli placebo . Le differenze non erano statisticamente significative, tuttavia, e le percentuali più elevate rientravano nell'intervallo di controllo storico per questi tumori nel ceppo Wistar.
La nimodipina non è risultata cancerogena in uno studio di 91 settimane sui topi, ma l'elevata dose di 1800 ppm di nimodipina nel mangime (da 546 a 774 mg/kg/giorno) ha ridotto l'aspettativa di vita degli animali. Gli studi sulla mutagenicità, inclusi i test di Ames, del micronucleo e della letale dominante, sono risultati negativi. La nimodipina non ha alterato la fertilità e le prestazioni riproduttive generali di ratti Wistar maschi e femmine a seguito di dosi orali fino a 30 mg/kg/die somministrate quotidianamente per più di 10 settimane nei maschi e 3 settimane nelle femmine prima dell'accoppiamento e continuate al giorno 7 di gravidanza. Questa dose in un ratto è circa 4 volte la dose clinica equivalente di 60 mg ogni 4 ore in un paziente di 50 kg.
Gravidanza: Categoria di gravidanza C. È stato dimostrato che la nimodipina ha un effetto teratogeno nei conigli himalayani. L'incidenza di malformazioni e feti rachitici è aumentata a dosi orali di 1 e 10 mg/kg/die somministrate (tramite sonda gastrica) dal giorno 6 al giorno 18 di gravidanza ma non a 3,0 mg/kg/die in uno dei due studi identici sui conigli. Nel secondo studio è stata osservata un'aumentata incidenza di feti rachitici a 1,0 mg/kg/die ma non a dosi più elevate. La nimodipina era embriotossica, causando riassorbimento e crescita stentata dei feti, nei ratti Long Evans a 100 mg/kg/die somministrati mediante sonda gastrica dal giorno 6 al giorno 15 di gravidanza. In altri due studi sui ratti, dosi di 30 mg/kg/die di nimodipina somministrate mediante sonda gastrica dal giorno 16 di gestazione e continuate fino al sacrificio (giorno 20 di gravidanza o giorno 21 dopo il parto) sono state associate a una maggiore incidenza di variazioni scheletriche, feti rachitici e nati morti ma senza malformazioni. Non ci sono studi adeguati e ben controllati nelle donne in gravidanza per valutare direttamente l'effetto sui feti umani. La nimodipina deve essere usata durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Madri che allattano: È stato dimostrato che la nimodipina e/o i suoi metaboliti sono presenti nel latte di ratto a concentrazioni molto più elevate rispetto al plasma materno. Non è noto se il farmaco venga escreto nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, si consiglia alle madri che allattano di non allattare al seno i loro bambini durante l'assunzione del farmaco.
Uso pediatrico: La sicurezza e l'efficacia nei bambini non sono state stabilite.
Uso geriatrico: Gli studi clinici sulla nimodipina non hanno incluso un numero sufficiente di soggetti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso dai soggetti più giovani. Altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e quelli più giovani. In generale, il dosaggio nei pazienti anziani deve essere prudente, a causa della maggiore frequenza di ridotta funzionalità epatica, renale o cardiaca e di malattie concomitanti o altre terapie farmacologiche.
OVERDOSE
Non sono stati segnalati casi di sovradosaggio dalla somministrazione orale di Nimotop® (nimodipina) . I sintomi da sovradosaggio dovrebbero essere correlati ad effetti cardiovascolari come un'eccessiva vasodilatazione periferica con marcata ipotensione sistemica. L'ipotensione clinicamente significativa dovuta al sovradosaggio di Nimotop® (nimodipina) può richiedere un supporto cardiovascolare attivo con agenti pressori. Devono essere somministrati tempestivamente anche trattamenti specifici per il sovradosaggio di calcioantagonisti. Poiché Nimotop® (nimodipina) è altamente legato alle proteine, è probabile che la dialisi non sia di beneficio.
CONTROINDICAZIONI
Nessuno noto.
FARMACOLOGIA CLINICA
Meccanismo di azione: La nimodipina è un calcio-antagonista. I processi contrattili delle cellule muscolari lisce dipendono dagli ioni calcio, che entrano in queste cellule durante la depolarizzazione sotto forma di lente correnti ioniche transmembrana. La nimodipina inibisce il trasferimento di ioni calcio in queste cellule e quindi inibisce le contrazioni della muscolatura liscia vascolare. Negli esperimenti sugli animali, la nimodipina ha avuto un effetto maggiore sulle arterie cerebrali che sulle arterie in altre parti del corpo forse perché è altamente lipofila, permettendole di attraversare la barriera ematoencefalica; concentrazioni di nimodipina fino a 12,5 ng/mL sono state rilevate nel liquido cerebrospinale di pazienti con emorragia subaracnoidea (SAH) trattati con nimodipina. Il preciso meccanismo d'azione della nimodipina nell'uomo è sconosciuto. Sebbene gli studi clinici descritti di seguito dimostrino un effetto favorevole della nimodipina sulla gravità dei deficit neurologici causati dal vasospasmo cerebrale in seguito a SAH, non ci sono prove arteriografiche che il farmaco prevenga o allevi lo spasmo di queste arterie. Tuttavia, non è noto se la metodologia arteriografica utilizzata fosse adeguata o meno per rilevare un effetto clinicamente significativo, se del caso, sul vasospasmo.
Farmacocinetica e metabolismo: Nell'uomo, la nimodipina viene assorbita rapidamente dopo somministrazione orale e le concentrazioni massime vengono generalmente raggiunte entro un'ora. L'emivita di eliminazione terminale è di circa 8-9 ore, ma i tassi di eliminazione precedenti sono molto più rapidi, equivalenti a un'emivita di 1-2 ore; una conseguenza è la necessità di somministrazioni frequenti (ogni 4 ore). Non ci sono stati segni di accumulo quando la nimodipina è stata somministrata tre volte al giorno per sette giorni. La nimodipina è legata per oltre il 95% alle proteine plasmatiche. Il legame era indipendente dalla concentrazione nell'intervallo da 10 ng/mL a 10 µg/mL. La nimodipina viene eliminata quasi esclusivamente sotto forma di metaboliti e meno dell'1% viene ritrovata nelle urine come farmaco immodificato. Sono stati identificati numerosi metaboliti, tutti inattivi o considerevolmente meno attivi del composto originario. A causa dell'elevato metabolismo di primo passaggio, la biodisponibilità della nimodipina è in media del 13% dopo somministrazione orale. La biodisponibilità è significativamente aumentata nei pazienti con cirrosi epatica, con una Cmax approssimativamente doppia rispetto ai pazienti normali, il che richiede un abbassamento della dose in questo gruppo di pazienti (vedi DOSAGGIO E SOMMINISTRAZIONE ). In uno studio su 24 volontari maschi sani, la somministrazione di capsule di nimodipina dopo una colazione standard ha determinato una concentrazione plasmatica di picco inferiore del 68% e una biodisponibilità inferiore del 38% rispetto al dosaggio a digiuno.
In un unico studio a gruppi paralleli che ha coinvolto 24 soggetti anziani (di età compresa tra 59 e 79 anni) e 24 soggetti più giovani (di età compresa tra 22 e 40 anni), l'AUC e la Cmax osservate di nimodipina erano circa 2 volte superiori nella popolazione anziana rispetto allo studio più giovane soggetti dopo somministrazione orale (somministrata come dose singola da 30 mg e dosata allo stato stazionario con 30 mg tre volte al giorno per 6 giorni). La risposta clinica a queste differenze farmacocinetiche legate all'età, tuttavia, non è stata considerata significativa. (Vedere PRECAUZIONI : Uso geriatrico.)
Test clinici: La nimodipina ha dimostrato, in 4 studi randomizzati, in doppio cieco, controllati con placebo, di ridurre la gravità dei deficit neurologici derivanti dal vasospasmo in pazienti che hanno avuto una recente emorragia subaracnoidea (SAH). Gli studi hanno utilizzato dosi comprese tra 20-30 mg e 90 mg ogni 4 ore, con il farmaco somministrato per 21 giorni in 3 studi e per almeno 18 giorni nell'altro. Tre dei quattro studi hanno seguito i pazienti per 3-6 mesi. Tre degli studi hanno studiato pazienti relativamente buoni, con tutti o la maggior parte dei pazienti di grado Hunt e Hess I - III (essenzialmente privi di deficit focali dopo l'emorragia iniziale) il quarto ha studiato pazienti molto più malati, Hunt e Hess di grado III - V. Due studi , uno statunitense, uno francese, erano simili nel disegno, con pazienti con SAH relativamente inalterati randomizzati a nimodipina o placebo. In ciascuno, è stato formulato un giudizio sul fatto che un qualsiasi deficit di sviluppo tardivo fosse dovuto a spasmo o altre cause e i deficit sono stati classificati. Entrambi gli studi hanno mostrato un numero significativamente inferiore di deficit gravi dovuti allo spasmo nel gruppo nimodipina; il secondo studio (francese) ha mostrato meno deficit legati allo spasmo di tutte le severità. Non è stato osservato alcun effetto sui deficit non correlati allo spasmo.
Un terzo, ampio studio è stato condotto nel Regno Unito su pazienti affetti da SAH con tutti i gradi di gravità (ma l'89% era di grado I-III). Alla nimodipina sono stati somministrati 60 mg ogni 4 ore. Gli esiti non sono stati definiti come correlati allo spasmo o meno, ma a 3 mesi si è verificata una significativa riduzione del tasso complessivo di infarto e un esito neurologico gravemente disabilitante:
Uno studio canadese ha coinvolto pazienti molto più malati (Hunt e Hess di grado III-V), che avevano un alto tasso di morte e disabilità, e usavano una dose di 90 mg ogni 4 ore, ma per il resto era simile ai primi due studi. L'analisi dei deficit ischemici ritardati, molti dei quali risultanti da spasmo, ha mostrato una significativa riduzione dei deficit correlati allo spasmo. Tra i pazienti analizzati (72 nimodipina, 82 placebo), si sono verificati i seguenti esiti.
Quando i dati sono stati combinati per gli studi canadese e del Regno Unito, la differenza di trattamento sulla percentuale di successo (cioè un buon recupero) sulla Glasgow Outcome Scale era del 25,3% (nimodipina) rispetto al 10,9% (placebo) per Hunt e Hess di grado IV o V. La tabella seguente dimostra che la nimodipina tende a migliorare il buon recupero dei pazienti affetti da SAH con uno scarso stato neurologico post-ictus, riducendo al contempo i numeri con disabilità grave e sopravvivenza vegetativa.
Uno studio di dosaggio che ha confrontato dosi di 30, 60 e 90 mg ha rilevato un tasso generalmente basso di deficit neurologici correlati allo spasmo ma nessuna relazione dose-risposta.
INFORMAZIONI PER IL PAZIENTE
Nessuna informazione fornita. Si prega di fare riferimento al AVVERTENZE e PRECAUZIONI sezioni.
