Rhinocort 100mcg Budesonide Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Cos'è Rhinocort Aqua e come si usa?
Lo spray nasale Rhinocort Aqua (budesonide) è uno steroide usato per trattare i sintomi nasali come congestione, starnuti e naso che cola causati da allergie stagionali o per tutto l'anno. Lo spray nasale Rhinocort Aqua viene utilizzato anche per impedire la ricomparsa dei polipi nasali dopo la rimozione chirurgica.
Quali sono gli effetti collaterali di Rhinocort 100mcg Aqua?
Gli effetti collaterali comuni dello spray nasale Rhinocort Aqua includono:
- secchezza o irritazione del naso/gola,
- mal di gola,
- tosse,
- starnutire,
- sangue dal naso,
- sapore/odore sgradevole,
- piaghe o macchie bianche all'interno o intorno al naso, o
- dolore, gonfiore, bruciore, prurito o irritazione intorno al naso.
Informi il medico se ha effetti collaterali rari ma gravi di Rhinocort Aqua spray nasale, tra cui:
- perdita del gusto o dell'olfatto, o
- dolore o piaghe al naso.
DESCRIZIONE
Budesonide, il principio attivo di RHINOCORT AQUA (budesonide) spray nasale, è un corticosteroide sintetico antinfiammatorio.
È designato chimicamente come (RS)-11-beta, 16-alfa, 17, 21-tetraidrossipregna-l,4-diene-3,20-dione ciclico 16, 17-acetale con butirraldeide.
Budesonide è fornito come miscela di due epimeri (22R e 22S).
La formula empirica della budesonide è C25H34O6 e il suo peso molecolare è 430,5.
La sua formula strutturale è:
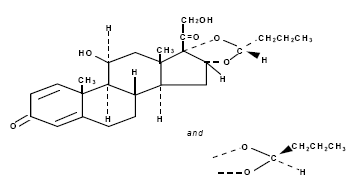
Budesonide è una polvere inodore da bianca a biancastra, praticamente insolubile in acqua e in eptano, poco solubile in etanolo e liberamente solubile in cloroformio.
Il suo coefficiente di ripartizione tra ottanolo e acqua a pH 5 è 1,6 x103.
RHINOCORT AQUA (budesonide) spray nasale è una formulazione spray a pompa manuale inodore, dosata, contenente una sospensione micronizzata di budesonide in un mezzo acquoso. In questo terreno sono contenuti cellulosa microcristallina e carbossimetilcellulosa sodica, destrosio anidro, polisorbato 80, disodio edetato, sorbato di potassio e acqua purificata; viene aggiunto acido cloridrico per regolare il pH a un obiettivo di 4,5.
RHINOCORT 100mcg AQUA spray nasale fornisce 32 mcg di budesonide per spray.
Ogni flacone di RHINOCORT 100 mcg AQUA (budesonide) spray nasale 32 mcg contiene 120 spray dosati dopo l'adescamento iniziale.
Prima dell'uso iniziale, il contenitore deve essere agitato delicatamente e la pompa deve essere adescata azionandola otto volte. Se utilizzata quotidianamente, la pompa non ha bisogno di essere ricaricata. Se non viene utilizzato per due giorni consecutivi, ricaricare con una spruzzata o fino a quando non appare una spruzzatura fine. Se non viene utilizzato per più di 14 giorni, risciacquare l'applicatore e ricaricare con due spruzzi o fino a quando appare uno spruzzo fine.
INDICAZIONI
Trattamento della rinite allergica stagionale o perenne
RHINOCORT AQUA (budesonide) spray nasale è indicato per il trattamento dei sintomi nasali della rinite allergica stagionale o perenne negli adulti e nei bambini di età pari o superiore a sei anni.
DOSAGGIO E SOMMINISTRAZIONE
La dose iniziale raccomandata per adulti e bambini di età pari o superiore a 6 anni è di 64 mcg al giorno somministrati come uno spray per narice di RHINOCORT AQUA (budesonide) spray nasale 32 mcg una volta al giorno. Alcuni pazienti che non ottengono il controllo dei sintomi alla dose iniziale raccomandata possono trarre beneficio da un aumento della dose. La dose massima raccomandata per gli adulti (di età pari o superiore a 12 anni) è di 256 mcg al giorno somministrati in quattro spruzzi per narice una volta al giorno di RHINOCORT AQUA (budesonide) spray nasale 32 mcg e la dose massima raccomandata per i pazienti pediatrici (da 6 a
È sempre auspicabile titolare un singolo paziente al dosaggio minimo efficace per ridurre la possibilità di effetti collaterali. Un miglioramento dei sintomi nasali può essere notato nei pazienti entro 10 ore dalla prima somministrazione di RHINOCORT 100mcg AQUA (budesonide) spray nasale, tuttavia, il miglioramento clinico richiede solitamente 1-2 giorni con il massimo beneficio in circa 2 settimane. Quando è stato raggiunto il massimo beneficio e i sintomi sono stati controllati, la riduzione del dosaggio può essere efficace nel mantenere il controllo dei sintomi della rinite allergica nei pazienti che inizialmente erano controllati con dosaggi più elevati.
Prima dell'uso iniziale, il contenitore deve essere agitato delicatamente e la pompa deve essere adescata azionandola otto volte. Se utilizzata quotidianamente, la pompa non ha bisogno di essere ricaricata. Se non viene utilizzato per due giorni consecutivi, ricaricare con una spruzzata o fino a quando non appare una spruzzatura fine. Se non viene utilizzato per più di 14 giorni, risciacquare l'applicatore e ricaricare con due spruzzi o fino a quando appare uno spruzzo fine. Agitare delicatamente il contenitore prima di ogni utilizzo.
Illustrato Istruzioni per l'uso del paziente accompagnare ogni confezione di RHINOCORT AQUA (budesonide) Spray nasale 32 mcg.
COME FORNITO
Forme di dosaggio e punti di forza
RHINOCORT AQUA (budesonide) spray nasale è una sospensione spray nasale. Ogni spruzzo fornisce 32 mcg di budesonide. Ogni flacone di RHINOCORT 100 mcg AQUA (budesonide) spray nasale 32 mcg contiene 120 spray dosati dopo l'adescamento iniziale.
RHINOCORT 100mcg AQUA (budesonide) Spray nasale 32 mcg è disponibile in un flacone di vetro ambrato con dosatore spray dosatore e tappo di protezione verde. RHINOCORT 100mcg AQUA (budesonide) Spray nasale 32 mcg ( NDC 0186-1070-08) fornisce 120 nebulizzazioni dosate dopo l'adescamento iniziale; peso netto di riempimento 8,6 g. Il flacone da 32 mcg di spray nasale RHINOCORT 100mcg AQUA (budesonide) è stato riempito con un eccesso per assecondare l'attività di adescamento. Il flacone deve essere eliminato dopo 120 nebulizzazioni successive all'adescamento iniziale, poiché la quantità di budesonide erogata per ogni nebulizzazione successiva può essere sostanzialmente inferiore alla dose indicata. Ogni spruzzo fornisce 32 mcg di budesonide al paziente.
RHINOCORT 100mcg AQUA (budesonide) spray nasale deve essere conservato a temperatura ambiente controllata, da 20 a 25°C (da 68 a 77°F) con la valvola aperta. Non congelare. Proteggi dalla luce. Agitare delicatamente prima dell'uso. Non spruzzare negli occhi.
Distribuito da: AstraZeneca LP, Wilmington, DE 19850. Revisionato: 12/2010
EFFETTI COLLATERALI
L'uso sistemico e intranasale di corticosteroidi può causare quanto segue:
- Epistassi, infezione da Candida albicans, perforazione del setto nasale e ridotta guarigione delle ferite [vedi AVVERTENZE E PRECAUZIONI ].
- Ipersensibilità inclusa l'anafilassi [vedi AVVERTENZE E PRECAUZIONI ].
- Immunosoppressione [vedi AVVERTENZE E PRECAUZIONI ].
- Ipercorticismo e soppressione surrenale [vedi AVVERTENZE E PRECAUZIONI ].
- Effetto di crescita [vedi AVVERTENZE E PRECAUZIONI e Utilizzare in popolazioni specifiche ].
- Glaucoma e cataratta [vedi AVVERTENZE E PRECAUZIONI ].
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
L'incidenza delle reazioni avverse comuni nella Tabella 1 si basa su due studi clinici controllati negli Stati Uniti e cinque non statunitensi in 1.526 pazienti con rinite stagionale o perenne in adulti e bambini di età ≥ 6 anni trattati con RHINOCORT AQUA (budesonide) spray nasale a dosi fino a 400 mcg una volta al giorno per 3-6 settimane. Questa popolazione comprendeva 745 femmine e 781 maschi con un'età media di 31 anni (range 6-85 anni, 349 avevano 6
Un profilo di reazioni avverse simile è stato osservato nel sottogruppo di pazienti pediatrici di età compresa tra 6 e 12 anni. Questi pazienti sono inclusi nella Tabella 1.
Il 2-3% (2-3%) dei pazienti negli studi clinici ha interrotto il trattamento a causa di reazioni avverse. Gli effetti collaterali sistemici dei corticosteroidi non sono stati segnalati durante gli studi clinici controllati con RHINOCORT AQUA (budesonide) spray nasale.
Se le dosi raccomandate vengono superate, o se gli individui sono particolarmente sensibili, potrebbero verificarsi sintomi di ipercorticismo, ad es. Sindrome di Gushing, e soppressione surrenalica.
Esperienza post marketing
Le seguenti reazioni avverse sono state riportate durante l'uso successivo all'approvazione di RHINOCORT AQUA (budesonide) spray nasale. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco.
Disturbi del sistema immunitario: reazioni di ipersensibilità immediate e ritardate (incluse reazione anafilattica, orticaria, eruzione cutanea, dermatite, angioedema e prurito), [vedere AVVERTENZE E PRECAUZIONI e CONTROINDICAZIONI ]
Disturbi dell'occhio: glaucoma, aumento della pressione intraoculare, cataratta [vedi AVVERTENZE E PRECAUZIONI ]
Patologie respiratorie, toraciche e mediastiniche: perforazione del setto nasale, anosmia, disturbi della faringe (irritazione della gola, dolore alla gola, gola gonfia, bruciore alla gola e prurito alla gola) e respiro sibilante
Patologie cardiache: palpitazioni
Patologie del sistema muscoloscheletrico e del tessuto connettivo: soppressione della crescita [vedi AVVERTENZE E PRECAUZIONI e Utilizzare in popolazioni specifiche ]
INTERAZIONI DI DROGA
Inibitori del citocromo P450 3A4
La principale via di metabolismo dei corticosteroidi, inclusa la budesonide, è l'isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP). Dopo somministrazione orale di ketoconazolo, un potente inibitore del CYP3A4, la concentrazione plasmatica media di budesonide somministrata per via orale è aumentata. La somministrazione concomitante di CYP3A4 può inibire il metabolismo e aumentare l'esposizione sistemica alla budesonide. Si deve usare cautela quando si considera la co-somministrazione di RHINOCORT AQUA (budesonide) spray nasale con ketoconazolo a lungo termine e altri noti inibitori potenti del CYP3A4 (p. es., ritonavir, atazanavir claritromicina, indinavir itraconazolo, nefazodone nelfinavir-saquinavir, telitromicina) [vedere AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ].
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Effetti nasali locali
Epistassi
Negli studi clinici di durata da 3 a 52 settimane, l'epistassi è stata osservata più frequentemente nei pazienti trattati con RHINOCORT 100 mcg AQUA (budesonide) spray nasale rispetto a quelli che hanno ricevuto placebo [vedere REAZIONI AVVERSE ].
Infezione da Candida
Negli studi clinici con budesonide somministrata per via intranasale, si è verificato lo sviluppo di infezioni localizzate del naso e della faringe con Candida albicans. Quando si sviluppa tale infezione, può essere necessario un trattamento con un'appropriata terapia locale o sistemica e l'interruzione del trattamento con RHINOCORT AQUA (budesonide) spray nasale. I pazienti che usano RHINOCORT AQUA (budesonide) spray nasale per diversi mesi o più devono essere esaminati periodicamente per verificare l'evidenza di infezione da Candida o altri segni di effetti avversi sulla mucosa nasale.
Perforazione del setto nasale
Sono stati segnalati casi di perforazione del setto nasale in seguito all'applicazione intranasale di corticosteroidi, inclusa budesonide [vedi REAZIONI AVVERSE ].
Guarigione delle ferite compromessa
A causa dell'effetto inibitorio dei corticosteroidi sulla guarigione delle ferite, i pazienti che hanno avuto recenti ulcere del setto nasale, chirurgia nasale o traumi nasali non devono usare un corticosteroide nasale fino a quando non si è verificata la guarigione.
Reazioni di ipersensibilità inclusa l'anafilassi
Possono verificarsi reazioni di ipersensibilità incluse reazione anafilattica, orticaria, eruzione cutanea, dermatite, angioedema e prurito [vedere CONTROINDICAZIONI e REAZIONI AVVERSE, Esperienza post-marketing ].
Immunosoppressione
pazienti che assumono farmaci che sopprimono il sistema immunitario sono più suscettibili alle infezioni rispetto agli individui sani. La varicella e il morbillo, ad esempio, possono avere un decorso più grave o addirittura fatale nei bambini o negli adulti suscettibili che assumono corticosteroidi. In tali bambini o adulti che non hanno avuto queste malattie o sono stati adeguatamente immunizzati, occorre prestare particolare attenzione per evitare l'esposizione. Non è noto come la dose, la via e la durata della somministrazione dei corticosteroidi influenzino il rischio di sviluppare un'infezione disseminata. Anche il contributo della malattia sottostante e/o del precedente trattamento con corticosteroidi al rischio non è noto. In caso di esposizione alla varicella, può essere indicata la terapia con immunoglobuline varicella zoster (VZIG) o immunoglobuline endovenose aggregate (WIG), a seconda dei casi. In caso di esposizione al morbillo, può essere indicata la profilassi con immunoglobuline intramuscolari (IG) raggruppate. (Vedere rispettivi foglietti illustrativi per informazioni complete sulla prescrizione di VZIG e IG ). Se si sviluppa la varicella, può essere preso in considerazione il trattamento con agenti antivirali.
Il decorso clinico dell'infezione da varicella o morbillo in pazienti in trattamento con corticosteroidi intranasali o per via inalatoria non è stato studiato. Sebbene non ci siano dati sui corticosteroidi intranasali, uno studio clinico ha esaminato la risposta immunitaria al vaccino contro la varicella in pazienti asmatici di età compresa tra 12 mesi e 8 anni che sono stati trattati con budesonide sospensione per inalazione.
Uno studio clinico in aperto e non randomizzato ha esaminato la risposta immunitaria al vaccino della varicella in 243 pazienti asmatici di età compresa tra 12 mesi e 8 anni che sono stati trattati con budesonide sospensione per inalazione da 0,25 mg a 1 mg al giorno (n=151) o terapia per l'asma senza corticosteroidi (n=92) (cioè, beta-agonisti, antagonisti dei recettori dei leucotrieni o cromoni). La percentuale di pazienti che hanno sviluppato un titolo anticorpale sieroprotettivo ≥ 5,0 (valore gpELISA) in risposta alla vaccinazione era simile nei pazienti trattati con budesonide sospensione per inalazione (85%) rispetto ai pazienti trattati con terapia per l'asma senza corticosteroidi (90%). Nessun paziente trattato con budesonide sospensione per inalazione ha sviluppato varicella a seguito della vaccinazione.
I corticosteroidi devono essere usati con cautela, se non del tutto, in pazienti con infezione da tubercolosi attiva o quiescente, infezioni fungine, batteriche, sistemiche virali o parassitarie non trattate; o herpes simplex oculare.
Effetti dell'asse ipotalamo-ipofisi-surrene
Ipercorticismo e soppressione surrenalica: quando gli steroidi intranasali vengono utilizzati a dosaggi superiori a quelli raccomandati o in soggetti predisposti ai dosaggi raccomandati, possono comparire effetti sistemici dei corticosteroidi come ipercorticismo e soppressione surrenalica. Se si verificano tali cambiamenti, il dosaggio di RHINOCORT 100 mcg AQUA (budesonide) spray nasale deve essere interrotto lentamente, coerentemente con le procedure accettate per l'interruzione della terapia con corticosteroidi orali.
La sostituzione di un corticosteroide sistemico con un corticosteroide topico può essere accompagnata da segni di insufficienza surrenalica e inoltre alcuni pazienti possono manifestare sintomi di astinenza da corticosteroidi, ad es. dolore articolare e/o muscolare, affaticamento, debolezza, nausea, vomito, ipotensione, stanchezza e depressione. I pazienti precedentemente trattati per periodi prolungati con corticosteroidi sistemici devono essere svezzati lentamente quando trasferiti a corticosteroidi topici e attentamente monitorati per l'insufficienza surrenalica acuta in risposta allo stress. In quei pazienti che hanno l'asma o altre condizioni cliniche che richiedono un trattamento a lungo termine con corticosteroidi sistemici, una diminuzione troppo rapida dei corticosteroidi sistemici può causare una grave esacerbazione dei loro sintomi.
Interazioni con potenti inibitori del citocromo P450 3A4
Si deve usare cautela quando si considera la co-somministrazione di RHINOCORT AQUA spray nasale con ketoconazolo e altri noti inibitori potenti del CYP3A4 (p. es., ritonavir, atazanavir, claritromicina, indinavir, itraconazolo, nefazodone, nelfinavir, saquinavir, telitromicina) perché gli effetti avversi sono può verificarsi un'esposizione sistemica alla budesonide [vedi INTERAZIONI FARMACI, FARMACOLOGIA CLINICA ].
Effetto sulla crescita
I corticosteroidi intranasali, inclusa la budesonide, possono causare una riduzione della velocità di crescita quando somministrati a pazienti pediatrici. Monitorare regolarmente la crescita dei pazienti pediatrici che ricevono un trattamento a lungo termine con RHINOCORT 100mcg AQUA (budesonide) spray nasale. Per ridurre al minimo gli effetti sistemici dei corticosteroidi intranasali, incluso RHINOCORT AQUA (budesonide) spray nasale, titolare il dosaggio di ciascun paziente al valore più basso che controlli efficacemente i suoi sintomi [vedi Uso in popolazioni specifiche, uso pediatrico ].
Glaucoma e Cataratta
Sono stati segnalati glaucoma, aumento della pressione intraoculare e cataratta in seguito all'applicazione intranasale di corticosteroidi, inclusa la budesonide. Pertanto, è necessario un attento monitoraggio nei pazienti con alterazioni della vista o con una storia di aumento della pressione intraoculare, glaucoma e/o cataratta [vedi REAZIONI AVVERSE ].
Informazioni di consulenza per il paziente
[Vedere Etichettatura del paziente approvata dalla FDA ]
I pazienti in trattamento con RHINOCORT 100mcg AQUA (budesonide) spray nasale devono ricevere le seguenti informazioni e istruzioni. Queste informazioni hanno lo scopo di aiutare il paziente nell'uso sicuro ed efficace del farmaco. Non è una divulgazione di tutti i possibili effetti negativi o previsti. Per un uso corretto di RHINOCORT 100mcg AQUA (budesonide) spray nasale e per ottenere il massimo miglioramento, il paziente deve leggere e seguire l'etichettatura del paziente approvata dalla FDA.
Effetti nasali locali
pazienti devono essere informati che epistassi e infezioni localizzate da Candida albicans si sono verificate nel naso e nella faringe in alcuni pazienti. Se si sviluppa candidosi, deve essere trattata con un'appropriata terapia locale o sistemica e interrompere il trattamento con RHINOCORT 100 mcg AQUA (budesonide) spray nasale. Inoltre, i corticosteroidi nasali sono associati alla perforazione del setto nasale e alla ridotta guarigione delle ferite. I pazienti che hanno avuto recenti ulcere nasali, interventi chirurgici nasali o traumi nasali non devono usare RHINOCORT AQUA (budesonide) spray nasale fino a quando non si è verificata la guarigione [vedere AVVERTENZE E PRECAUZIONI ].
Ipersensibilità inclusa anafilassi
I pazienti devono essere informati che con l'uso di RHINOCORT AQUA (budesonide) spray nasale sono state riportate reazioni di ipersensibilità comprese reazioni anafilattiche, orticaria, rash, dermatite, angioedema e prurito. Interrompere
RHINOCORT AQUA (budesonide) Spray nasale se si verificano tali reazioni [vedi CONTROINDICAZIONI, AVVERTENZE E PRECAUZIONI e REAZIONI AVVERSE ].
Immunosoppressione
I pazienti che assumono dosi di corticosteroidi immunosoppressori devono essere avvertiti di evitare l'esposizione alla varicella o al morbillo e, se esposti, di consultare il proprio medico senza indugio. I pazienti devono essere informati del potenziale peggioramento della tubercolosi esistente, dell'infezione fungina, batterica, virale o parassitaria o dell'herpes simplex oculare [vedi AVVERTENZE E PRECAUZIONI ].
Velocità di crescita ridotta
I pazienti devono essere informati che i corticosteroidi intranasali, inclusa la budesonide, possono causare una riduzione della velocità di crescita quando somministrati a pazienti pediatrici. I medici devono seguire da vicino la crescita di bambini e adolescenti che assumono corticosteroidi per qualsiasi via [vedi AVVERTENZE E PRECAUZIONI ].
Glaucoma e Cataratta
I pazienti devono essere informati che l'uso a lungo termine di corticosteroidi intranasali, inclusa la budesonide, può aumentare il rischio di alcuni problemi agli occhi (cataratta e glaucoma). I pazienti devono informare il proprio medico se si nota un cambiamento nella vista durante l'uso di RHINOCORT AQUA (budesonide) spray nasale [vedi AVVERTENZE E PRECAUZIONI ].
Usa ogni giorno
I pazienti devono usare RHINOCORT 100mcg AQUA (budesonide) spray nasale a intervalli regolari poiché la sua efficacia dipende dal suo uso regolare. I pazienti possono notare un miglioramento dei sintomi nasali entro 10 ore dalla prima somministrazione di RHINOCORT AQUA (budesonide) spray nasale. Il massimo beneficio potrebbe non essere raggiunto fino a circa 2 settimane dopo l'inizio del trattamento [vedi DOSAGGIO E SOMMINISTRAZIONE ].
pazienti devono assumere il farmaco come indicato e non devono superare il dosaggio prescritto. Il paziente deve contattare il medico se i sintomi non migliorano dopo due settimane o se la condizione peggiora. I pazienti che manifestano episodi ricorrenti di epistassi (epistassi) o disturbi del setto nasale durante l'assunzione di questo farmaco devono contattare il proprio medico. Per un uso corretto di RHINOCORT AQUA (budesonide) spray nasale e per ottenere il massimo miglioramento, il paziente deve leggere e seguire attentamente le informazioni relative al paziente. Non utilizzare RHINOCORT 100mcg AQUA (budesonide) spray nasale dopo che è stato utilizzato il numero di spray indicato sull'etichetta (non include l'adescamento) o dopo la data di scadenza indicata sull'etichetta della confezione o del flacone.
Come usare RHINOCORT 100mcg AQUA (budesonide) Spray nasale
I pazienti devono essere accuratamente istruiti sull'uso di questo medicinale per assicurare un'erogazione ottimale della dose [vedi INFORMAZIONI PER IL PAZIENTE ].
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
In uno studio orale di 104 settimane su ratti Sprague-Dawley, è stato osservato un aumento statisticamente significativo dell'incidenza di gliomi nei ratti maschi che hanno ricevuto una dose orale di budesonide 50 mcg/kg/die (circa il doppio della dose intranasale giornaliera massima raccomandata nel adulti e bambini su base mcg/m2). Non è stata osservata tumorigenicità nei ratti maschi a dosi orali fino a 25 mcg/kg (circa uguale alla dose intranasale giornaliera massima raccomandata negli adulti e nei bambini su base mcg/m2, e nelle femmine di ratto a dosi orali fino a 50 mcg/kg circa due volte la dose intranasale giornaliera massima raccomandata negli adulti e nei bambini su base mcg/m2). In due ulteriori studi di due anni su ratti maschi Fischer e Sprague-Dawley, budesonide non ha causato gliomi a una dose orale di 50 mcg/kg (circa il doppio della dose intranasale giornaliera massima raccomandata negli adulti e nei bambini su base mcg/m2). Tuttavia, nei ratti maschi Sprague-Dawley, budesonide ha causato un aumento statisticamente significativo dell'incidenza di tumori epatocellulari a una dose orale di 50 mcg/kg (circa il doppio della dose intranasale giornaliera massima raccomandata negli adulti e nei bambini sulla base di mcg/m2). ). I corticosteroidi di riferimento simultanei (prednisolone e triamcinolone acetonide) in questi due studi hanno mostrato risultati simili.
Non sono emerse evidenze di un effetto cancerogeno quando budesonide è stata somministrata per via orale per 91 settimane a topi a dosi fino a 200 mcg/kg/die (circa 3 volte la dose intranasale giornaliera massima raccomandata negli adulti e nei bambini su base mcg/m2) .
Budesonide non è risultata mutagena o clastogenica in sei diversi sistemi di test: test della Salmonella/microsoma di Ames, test del micronucleo del topo, test del linfoma del topo, test dell'aberrazione cromosomica nei linfociti umani, test letale recessivo legato al sesso nella Drosophila melanogaster e analisi della riparazione del DNA nel ratto coltura di epatociti.
Nei ratti, budesonide non ha avuto effetti sulla fertilità a dosi sottocutanee fino a 80 mcg/kg (circa 3 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2).
una dose sottocutanea di 20 mcg/kg/die (inferiore alla dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2), diminuisce l'aumento di peso corporeo materno, la vitalità prenatale e la vitalità dei piccoli alla nascita e durante l'allattamento sono stati osservati. Non sono stati osservati tali effetti a 5 mcg/kg (inferiore alla dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2).
Utilizzare in popolazioni specifiche
Gravidanza
Effetti teratogeni: Categoria di gravidanza B. L'impatto della budesonide sugli esiti della gravidanza umana è stato valutato attraverso valutazioni dei registri delle nascite collegati all'uso materno di budesonide per via inalatoria (es. PULMICORT TURBUHALER) e budesonide somministrata per via nasale (es. RHINOCORT 100mcg AQUA (budesonide) spray nasale). I risultati di studi epidemiologici di coorte prospettici basati sulla popolazione che esaminano i dati di tre registri svedesi che coprono circa il 99% delle gravidanze dal 1995 al 2001 (cioè, registro svedese delle nascite mediche; registro delle malformazioni congenite; registro di cardiologia infantile) non indicano un aumento del rischio globale malformazioni congenite dovute all'uso di budesonide per via inalatoria o intranasale durante l'inizio della gravidanza.
Le malformazioni congenite sono state studiate in 2.014 bambini nati da madri che hanno riportato l'uso di budesonide per via inalatoria per l'asma all'inizio della gravidanza (di solito 10-12 settimane dopo l'ultimo periodo mestruale), il periodo in cui si verificano la maggior parte delle principali malformazioni d'organo.1 Il tasso di malformazioni congenite complessive era simile rispetto al tasso di popolazione generale (rispettivamente 3,8 % contro 3,5 %). Il numero di bambini nati con schisi orofacciali e difetti cardiaci era simile al numero previsto nella popolazione generale (4 bambini contro 3,3 e 18 bambini contro 17-18, rispettivamente). In uno studio di follow-on che ha portato il numero totale di neonati a 2.534, il tasso di malformazioni congenite complessive tra i neonati le cui madri erano state esposte alla budesonide per via inalatoria durante l'inizio della gravidanza non era diverso dal tasso di tutti i neonati nello stesso periodo (3,6% ).2 Un terzo studio dal registro delle nascite mediche svedese su 2.968 gravidanze esposte alla budesonide per via inalatoria, la maggior parte delle quali erano esposizioni nel primo trimestre, riportavano età gestazionale, peso alla nascita, lunghezza alla nascita, nati morti e nascite multiple simili per i bambini esposti rispetto a neonati non esposti.3
Le malformazioni congenite sono state studiate in 2.113 bambini nati da madri che hanno riportato l'uso di budesonide intranasale all'inizio della gravidanza. Il tasso di malformazioni congenite complessive era simile rispetto al tasso di popolazione generale (4,5% vs 3,5%, rispettivamente). L'odds ratio (OR) aggiustato era 1,06 (IC 95% 0,86-1,31). Il numero di bambini nati con schisi orofacciali era simile al numero previsto nella popolazione generale (3 bambini contro 3, rispettivamente). Il numero di bambini nati con difetti cardiaci ha superato quello atteso nella popolazione generale (rispettivamente 28 bambini vs. 17,8). L'esposizione sistemica alla budesonide intranasale è 6 volte inferiore rispetto alla budesonide per via inalatoria e non è stata osservata un'associazione di difetti cardiaci con esposizioni più elevate di budesonide.
Nonostante i risultati sugli animali, sembrerebbe che la possibilità di danno fetale sia remota se il farmaco viene utilizzato durante la gravidanza. Tuttavia, poiché gli studi sull'uomo non possono escludere la possibilità di danni, RHINOCORT AQUA (budesonide) spray nasale deve essere utilizzato durante la gravidanza solo se chiaramente necessario.
Budesonide ha prodotto perdita fetale, diminuzione del peso dei cuccioli e anomalie scheletriche a una dose sottocutanea nei conigli che era circa 2 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2 e a una dose sottocutanea nei ratti che era circa 16 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2. Non sono stati osservati effetti teratogeni o embriocidi nei ratti quando budesonide è stata somministrata per inalazione a dosi fino a circa 8 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2.
L'esperienza con i corticosteroidi orali sin dalla loro introduzione in farmacologia, al contrario delle dosi fisiologiche, suggerisce che i roditori sono più inclini agli effetti teratogeni dei corticosteroidi rispetto agli esseri umani.
Effetti non teratogeni: L'iposurrenalismo può verificarsi nei bambini nati da madri che ricevono corticosteroidi durante la gravidanza. Tali bambini dovrebbero essere attentamente osservati.
Madri che allattano
La budesonide è secreta nel latte materno. I dati relativi alla budesonide somministrata tramite inalatore di polvere secca indicano che la dose orale giornaliera totale di budesonide disponibile nel latte materno per il bambino è compresa tra lo 0,3% e l'1% circa della dose inalata dalla madre [vedere FARMACOLOGIA CLINICA, Farmacocinetica, Popolazioni Speciali, Infermieristica ]. Non sono stati condotti studi in donne che allattano al seno in particolare con RHINOCORT 100mcg AQUA spray nasale; tuttavia, la dose di budesonide disponibile per il neonato nel latte materno, come percentuale della dose materna, dovrebbe essere simile. RHINOCORT AQUA (budesonide) spray nasale deve essere utilizzato nelle donne che allattano solo se clinicamente appropriato. I prescrittori dovrebbero valutare i benefici noti dell'allattamento al seno per la madre e il bambino rispetto ai potenziali rischi di un'esposizione minima alla budesonide nel bambino. Le considerazioni sul dosaggio includono la prescrizione o la titolazione alla dose clinicamente efficace più bassa e l'uso di RHINOCORT 100 mcg AQUA (budesonide) spray nasale immediatamente dopo l'allattamento al seno per massimizzare l'intervallo di tempo tra la somministrazione e l'allattamento al seno per ridurre al minimo l'esposizione del bambino.
Uso pediatrico
La sicurezza e l'efficacia nei pazienti pediatrici di età inferiore ai 6 anni non sono state stabilite.
Studi clinici controllati hanno dimostrato che i corticosteroidi intranasali possono causare una riduzione della velocità di crescita nei pazienti pediatrici. Questo effetto è stato osservato in assenza di prove di laboratorio della soppressione dell'asse ipotalamo-ipofisi-surrene (HPA), suggerendo che la velocità di crescita è un indicatore più sensibile dell'esposizione sistemica ai corticosteroidi nei pazienti pediatrici rispetto ad alcuni test comunemente usati della funzione dell'asse HPA . Gli effetti a lungo termine di questa riduzione della velocità di crescita associata ai corticosteroidi intranasali, compreso l'impatto sull'altezza finale dell'adulto, non sono noti. Il potenziale di crescita "recupero" dopo l'interruzione del trattamento con corticosteroidi intranasali non è stato adeguatamente studiato.
La crescita dei pazienti pediatrici che ricevono corticosteroidi intranasali, incluso RHINOCORT 100 mcg AQUA (budesonide) spray nasale, deve essere monitorata di routine (p. es., tramite stadiometria). I potenziali effetti sulla crescita di un trattamento prolungato devono essere valutati rispetto ai benefici clinici ottenuti e ai rischi e benefici associati alle terapie alternative. Per ridurre al minimo gli effetti sistemici dei corticosteroidi intranasali, incluso RHINOCORT AQUA (budesonide) spray nasale, ogni paziente deve essere titolato alla dose più bassa che controlli efficacemente i suoi sintomi.
È stato condotto uno studio sulla crescita clinica controllato con placebo della durata di un anno in 229 pazienti pediatrici (di età compresa tra 4 e 8 anni) per valutare l'effetto di RHINOCORT AQUA (budesonide) spray nasale (dose singola giornaliera di 64 mcg, la dose iniziale raccomandata per bambini dai 6 anni in su) sulla velocità di crescita. Da una popolazione di 141 pazienti che hanno ricevuto RHINOCORT 100 mcg AQUA (budesonide) spray nasale e 67 che hanno ricevuto placebo, la stima puntuale della velocità di crescita con RHINOCORT AQUA (budesonide) spray nasale è stata di 0,25 cm/anno inferiore a quella osservata con il placebo (intervallo di confidenza al 95% da 0,59 cm/anno in meno rispetto al placebo a 0,08 cm/anno in più rispetto al placebo).
In uno studio su bambini asmatici di età compresa tra 5 e 12 anni, quelli trattati con budesonide somministrata tramite un inalatore di polvere secca 200 mcg due volte al giorno (n=311) hanno avuto una riduzione della crescita di 1,1 centimetri (0,433 pollici) rispetto a quelli trattati con placebo ( n=418) alla fine di un anno; la differenza tra questi due gruppi di trattamento non è aumentata ulteriormente in tre anni di trattamento aggiuntivo. Entro la fine dei quattro anni, i bambini trattati con budesonide inalatore di polvere secca e i bambini trattati con placebo avevano velocità di crescita simili. Le conclusioni tratte da questo studio possono essere confuse dall'uso ineguale di corticosteroidi nei gruppi di trattamento e dall'inclusione di dati di pazienti che hanno raggiunto la pubertà nel corso dello studio.
Gli effetti sistemici dei corticosteroidi per via inalatoria sono correlati all'esposizione sistemica a tali farmaci. Studi di farmacocinetica hanno dimostrato che sia negli adulti che nei bambini, l'esposizione sistemica alla budesonide alle dosi più elevate raccomandate di RHINOCORT AQUA (budesonide) spray nasale non dovrebbe essere maggiore dell'esposizione alle dosi più basse raccomandate tramite un inalatore di polvere secca. Pertanto, gli effetti sistemici (asse HPA e crescita) della budesonide rilasciata da RHINOCORT AQUA (budesonide) spray nasale non dovrebbero essere maggiori di quelli riportati per la budesonide per via inalatoria quando somministrata tramite l'inalatore di polvere secca.
Non si può escludere la possibilità che RHINOCORT 100 mcg AQUA (budesonide) spray nasale causi una soppressione della crescita in pazienti suscettibili o quando somministrato a dosi superiori a 64 mcg al giorno. L'intervallo di dosaggio raccomandato nei pazienti di età compresa tra 6 e 11 anni è compreso tra 64 e 128 mcg al giorno [vedere DOSAGGIO E SOMMINISTRAZIONE ].
Uso geriatrico
Dei 2.461 pazienti negli studi clinici su RHINOCORT 100 mcg AQUA (budesonide) spray nasale, il 5% aveva 60 anni e più. Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra questi soggetti e i soggetti più giovani, ad eccezione di una reazione avversa che ha riportato una frequenza di epistassi che aumenta con l'età. Inoltre, altre esperienze cliniche riportate non hanno identificato altre differenze nelle risposte tra i pazienti anziani e quelli più giovani, ma non può essere esclusa una maggiore sensibilità di alcuni individui più anziani.
Insufficienza epatica
Non sono stati condotti studi formali di farmacocinetica con RHINOCORT 100mcg AQUA (budesonide) spray nasale in pazienti con compromissione epatica. Tuttavia, poiché la budesonide viene eliminata principalmente dal metabolismo epatico, la compromissione della funzionalità epatica può portare all'accumulo di budesonide nel plasma. Pertanto, i pazienti con malattia epatica devono essere attentamente monitorati.
OVERDOSE
Un sovradosaggio acuto con questa forma di dosaggio è improbabile poiché un flacone da 120 spray di RHINOCORT 100 mcg AQUA (budesonide) spray nasale 32 mcg contiene solo circa 5,4 mg di budesonide. Il sovradosaggio cronico può causare segni/sintomi di ipercorticismo [vedi AVVERTENZE E PRECAUZIONI ].
CONTROINDICAZIONI
RHINOCORT AQUA (budesonide) spray nasale è controindicato nei pazienti con ipersensibilità a uno qualsiasi dei suoi componenti [vedi AVVERTENZE E PRECAUZIONI ].
FARMACOLOGIA CLINICA
Meccanismo di azione
Budesonide è un corticosteroide antinfiammatorio che mostra una potente attività glucocorticoide e una debole attività mineralcorticoide. Nei modelli standard in vitro e animali, budesonide ha un'affinità circa 200 volte maggiore per il recettore dei glucocorticoidi e una potenza antinfiammatoria topica 1000 volte superiore rispetto al cortisolo (test dell'edema dell'orecchio con olio di crotone di ratto). Come misura dell'attività sistemica, la budesonide è 40 volte più potente del cortisolo quando somministrata per via sottocutanea e 25 volte più potente quando somministrata per via orale nel test di involuzione del timo di ratto. Il significato clinico di questo è sconosciuto.
L'attività di RHINOCORT 100mcg AQUA spray nasale è dovuta al farmaco progenitore, budesonide. Negli studi sull'affinità del recettore dei glucocorticoidi, la forma 22R era due volte più attiva dell'epimero 22S. Studi in vitro hanno indicato che le due forme di budesonide non si convertono tra loro.
Il meccanismo preciso dell'azione dei corticosteroidi sull'infiammazione nella rinite allergica stagionale e perenne non è ben noto. L'infiammazione è una componente importante nella patogenesi della rinite allergica stagionale e perenne. I corticosteroidi hanno un'ampia gamma di attività inibitorie contro più tipi cellulari (p. es., mastociti, eosinofili, neutrofili, macrofagi e linfociti) e mediatori (p. es., istamina, eicosanoidi, leucotrieni e citochine) coinvolti in reazioni allergiche e non allergiche mediate infiammazione. Queste azioni antinfiammatorie dei corticosteroidi possono contribuire alla loro efficacia nella rinite allergica stagionale e perenne.
Farmacodinamica
Uno studio clinico di 3 settimane sulla rinite stagionale, che ha confrontato RHINOCORT 100 mcg di inalatore nasale, budesonide per via orale e placebo in 98 pazienti con rinite allergica dovuta al polline di betulla, ha dimostrato che l'effetto terapeutico di RHINOCORT inalatore nasale può essere attribuito agli effetti topici di budesonide.

Effetti dell'asse HPA
Gli effetti di RHINOCORT 100mcg AQUA (budesonide) spray nasale sulla funzione surrenale sono stati valutati in diversi studi clinici. In uno studio clinico di quattro settimane, 61 pazienti adulti che hanno ricevuto 256 mcg al giorno di RHINOCORT AQUA (budesonide) spray nasale non hanno dimostrato differenze significative rispetto ai pazienti trattati con placebo nei livelli plasmatici di cortisolo misurati prima e 60 minuti dopo 0,25 mg di cosintropina intramuscolare. Non ci sono state differenze consistenti nelle misurazioni del cortisolo urinario nelle 24 ore nei pazienti che ricevevano fino a 400 mcg al giorno. Risultati simili sono stati osservati in uno studio su 150 bambini e adolescenti di età compresa tra 6 e 17 anni affetti da rinite perenne che sono stati trattati con 256 mcg al giorno per un massimo di 12 mesi.
Dopo il trattamento con la dose massima giornaliera raccomandata di RHINOCORT AQUA (budesonide) spray nasale (256 mcg) per sette giorni, si è verificata una piccola, ma statisticamente significativa diminuzione dell'area sotto la curva del tempo cortisolo plasmatico nelle 24 ore (AUC0-24h ) in volontari adulti sani.
È stata osservata una soppressione dose-correlata dell'escrezione urinaria di cortisolo nelle 24 ore dopo la somministrazione di dosi di spray nasale di RHINOCORT AQUA (budesonide) comprese tra 100 e 800 mcg al giorno per un massimo di quattro giorni in 78 volontari adulti sani. La rilevanza clinica di questi risultati non è nota.
Farmacocinetica
Assorbimento
Dopo somministrazione intranasale di una singola dose di RHINOCORT AQUA (budesonide) spray nasale (128 mcg), la concentrazione plasmatica media di picco di circa 0,3 nmol/L si verifica circa 0,5 ore dopo la dose. Rispetto a una dose endovenosa, circa il 34% della dose intranasale erogata raggiunge la circolazione sistemica, la maggior parte della quale viene assorbita attraverso la mucosa nasale. Sebbene la budesonide sia ben assorbita dal tratto gastrointestinale, la biodisponibilità orale della budesonide è bassa (~10%) principalmente a causa dell'esteso metabolismo di primo passaggio nel fegato.
Distribuzione
Il volume di distribuzione della budesonide era di circa 2-3 L/kg. Era legato per l'85-90% alle proteine plasmatiche. Il volume di distribuzione dell'epimero 22R è quasi il doppio di quello dell'epimero 22 S. Il legame proteico è stato costante in un intervallo di concentrazione (1-100 nmol/L) raggiunto e superato le dosi raccomandate di RHINOCORT 100 mcg AQUA spray nasale. Budesonide ha mostrato scarso o nessun legame con la globulina legante i corticosteroidi. Budesonide si è rapidamente equilibrato con i globuli rossi in modo indipendente dalla concentrazione con un rapporto sangue/plasma di circa 0,8.
Metabolismo
Studi in vitro con omogenati epatici umani hanno dimostrato che la budesonide viene metabolizzata rapidamente e ampiamente. Due principali metaboliti formati tramite la biotrasformazione catalizzata dall'isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP) sono stati isolati e identificati come 16α-idrossiprednisolone e 6p-idrossibudesonide. L'attività corticosteroidea di ciascuno di questi due metaboliti è inferiore all'1% di quella del composto originario. Non è stata rilevata alcuna differenza qualitativa tra i modelli metabolici in vitro e in vivo. Una trascurabile inattivazione metabolica è stata osservata nel polmone umano e nei preparati sierici.
Escrezione/eliminazione
La forma 22R di budesonide è stata eliminata preferenzialmente dal fegato con una clearance sistemica di 1,4 L/min rispetto a 1,0 L/min per la forma 22S. L'emivita terminale, da 2 a 3 ore, era la stessa per entrambi gli epimeri ed era indipendente dalla dose. Budesonide è stata escreta nelle urine e nelle feci sotto forma di metaboliti. Circa 2/3 di una dose radiomarcata intranasale è stata ritrovata nelle urine e il resto nelle feci. Nelle urine non è stata rilevata budesonide immodificata.
Popolazioni specifiche
geriatrico
La farmacocinetica di RHINOCORT 100mcg AQUA (budesonide) spray nasale nei pazienti geriatrici non è stata studiata in modo specifico.
pediatrico
Dopo la somministrazione di RHINOCORT 100 mcg AQUA (budesonide) spray nasale, il tempo per raggiungere le concentrazioni massime del farmaco e l'emivita plasmatica erano simili nei bambini e negli adulti. I bambini avevano concentrazioni plasmatiche circa due volte quelle osservate negli adulti, principalmente a causa delle differenze di peso tra bambini e adulti.
Genere
Non è stato condotto alcuno studio farmacocinetico specifico per valutare l'effetto del sesso sulla farmacocinetica della budesonide. Tuttavia, a seguito della somministrazione di 400 mcg di RHINOCORT 100 mcg AQUA (budesonide) spray nasale a 7 volontari maschi e 8 femmine in uno studio di farmacocinetica, non sono state riscontrate differenze di genere nei parametri farmacocinetici.
Gara
Nessuno studio specifico è stato intrapreso per valutare l'effetto della razza sulla farmacocinetica della budesonide.
Madri che allattano
La disposizione della budesonide quando somministrata per inalazione orale da un inalatore di polvere secca a dosi di 200 o 400 mcg due volte al giorno per almeno 3 mesi è stata studiata in otto donne che allattano con asma da 1 a 6 mesi dopo il parto. L'esposizione sistemica alla budesonide in queste donne sembra essere paragonabile a quella delle donne che non allattano con asma da altri studi. Il latte materno ottenuto oltre otto ore dopo la somministrazione ha rivelato che la concentrazione massima di budesonide per le dosi da 400 e 800 mcg era rispettivamente di 0,39 e 0,78 nmol/L e si è verificata entro 45 minuti dalla somministrazione. La dose orale giornaliera stimata di budesonide dal latte materno al neonato era di circa 0,007 e 0,014 mcg/kg/die per i due regimi posologici utilizzati in questo studio, che rappresentano circa lo 0,3%-1% della dose inalata dalla madre. I livelli di budesonide nei campioni plasmatici ottenuti da cinque neonati a circa 90 minuti dopo l'allattamento al seno (e circa 140 minuti dopo la somministrazione del farmaco alla madre) erano al di sotto dei livelli quantificabili ( Utilizzare in popolazioni specifiche, madri che allattano ].
Insufficienza renale o epatica
La farmacocinetica della budesonide non è stata studiata in pazienti con insufficienza renale. La ridotta funzionalità epatica può influenzare l'eliminazione dei corticosteroidi. La farmacocinetica della budesonide è stata influenzata dalla funzionalità epatica compromessa, come evidenziato da una doppia disponibilità sistemica dopo l'ingestione orale. La rilevanza di questo risultato rispetto alla budesonide somministrata per via nasale non è stata stabilita.
Interazioni farmacologiche
Inibitori degli enzimi del citocromo P450
Ketoconazolo: Il ketoconazolo, un forte inibitore dell'isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP), il principale enzima metabolico dei corticosteroidi, aumenta i livelli plasmatici di budesonide per via orale [vedi AVVERTENZE E PRECAUZIONI e INTERAZIONI DI DROGA ].
Cimetidina: Alle dosi raccomandate, la cimetidina, un inibitore non specifico degli enzimi CYP, ha avuto un effetto lieve ma clinicamente insignificante sulla farmacocinetica della budesonide orale.
Tossicologia e/o farmacologia animale
La budesonide è risultata teratogena ed embricida nei conigli e nei ratti. Budesonide ha prodotto perdita fetale, diminuzione del peso dei cuccioli e anomalie scheletriche a una dose sottocutanea di 25 mcg/kg nei conigli (circa 2 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2) e a una dose sottocutanea di 500 mcg /kg nei ratti (circa 16 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2). Non sono stati osservati effetti teratogeni o embriocidi nei ratti quando budesonide è stata somministrata per inalazione fino a 250 mcg/kg (circa 8 volte la dose intranasale giornaliera massima raccomandata negli adulti su base mcg/m2).
Studi clinici
L'efficacia terapeutica di RHINOCORT AQUA (budesonide) spray nasale è stata valutata in studi clinici controllati con placebo sulla rinite allergica stagionale e perenne della durata di 3-6 settimane.
Il numero di pazienti trattati con budesonide in questi studi era di 90 maschi e 51 femmine di età compresa tra 6 e 12 anni e 691 maschi e 694 femmine di età pari o superiore a 12 anni. I pazienti erano prevalentemente caucasici.
Nel complesso, i risultati di questi studi clinici hanno mostrato che RHINOCORT AQUA (budesonide) spray nasale somministrato una volta al giorno fornisce una riduzione statisticamente significativa della gravità dei sintomi nasali della rinite allergica stagionale e perenne, inclusi naso che cola, starnuti e congestione nasale.
Un miglioramento dei sintomi nasali può essere notato nei pazienti entro 10 ore dalla prima somministrazione di RHINOCORT 100 mcg AQUA (budesonide) spray nasale. Questo tempo di insorgenza è supportato da uno studio dell'unità di esposizione ambientale in pazienti con rinite allergica stagionale che ha dimostrato che RHINOCORT 100 mcg AQUA (budesonide) spray nasale ha portato a un miglioramento statisticamente significativo dei sintomi nasali rispetto al placebo di 10 ore. Ulteriore supporto viene da uno studio clinico su pazienti con rinite allergica perenne che ha dimostrato un miglioramento statisticamente significativo dei sintomi nasali sia per RHINOCORT AQUA (budesonide) spray nasale che per il comparatore attivo (mometasone furoato) rispetto al placebo entro 8 ore. L'esordio è stato valutato anche in questo studio con il picco del flusso inspiratorio nasale e questo endpoint non ha mostrato efficacia per nessuno dei due trattamenti attivi. Sebbene in questi studi siano stati osservati miglioramenti statisticamente significativi dei sintomi nasali rispetto al placebo entro 8-10 ore, circa da metà a due terzi del miglioramento clinico finale con RHINOCORT 100 mcg AQUA (budesonide) spray nasale si verifica nei primi 1-2 giorni, e il massimo beneficio potrebbe non essere raggiunto fino a circa 2 settimane dopo l'inizio del trattamento.
RIFERIMENTI
Kallen B, Rydhstroem H, Aberg A. Malformazioni congenite dopo l'uso di budesonide per via inalatoria all'inizio della gravidanza. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Uso di farmaci durante la gravidanza: metodo di registrazione svedese unico che può essere migliorato. Agenzia svedese per i prodotti medici 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Risultati di gravidanza normali in uno studio di popolazione che includeva 2968 donne in gravidanza esposte alla budesonide. J Allergy Clin Immunol 2003;! 11:736-742.
INFORMAZIONI PER IL PAZIENTE
RHINOCORT 100mcg AQUA (budesonide) ® (RINE-o-cort AH-kwa) (budesonide) Spray nasale
Da usare solo nel naso
Leggi le informazioni per il paziente fornite con RHINOCORT 100mcg AQUA (budesonide) spray nasale prima di iniziare a usarlo e ogni volta che ricevi una ricarica. Potrebbero esserci nuove informazioni. Queste informazioni non sostituiscono il colloquio con il tuo medico in merito alla tua condizione medica o al trattamento. Se hai domande su RHINOCORT AQUA (budesonide) spray nasale, chiedi al tuo medico o al farmacista.
Che cos'è RHINOCORT 100mcg AQUA (budesonide) spray nasale?
RHINOCORT AQUA (budesonide) spray nasale è un medicinale soggetto a prescrizione medica usato per il trattamento dei sintomi di allergia stagionale e per tutto l'anno negli adulti e nei bambini di età pari o superiore a 6 anni.
RHINOCORT AQUA spray nasale contiene budesonide, che è un corticosteroide artificiale (sintetico). I corticosteroidi intranasali sono ormoni naturali presenti nel corpo che riducono il gonfiore del rivestimento del naso. Quando si spruzza RHINOCORT 100mcg AQUA (budesonide) spray nasale nel naso, aiuta a ridurre i sintomi nasali della rinite allergica (infiammazione del rivestimento del naso), come naso chiuso, naso che cola, prurito e starnuti.
La sicurezza e l'efficacia di RHINOCORT 100mcg AQUA (budesonide) spray nasale non sono state dimostrate nei bambini di età inferiore ai 6 anni.
Chi non dovrebbe usare RHINOCORT AQUA (budesonide) spray nasale?
Non utilizzare RHINOCORT 100mcg AQUA (budesonide) Spray nasale:
- se è allergico alla budesonide o ad uno qualsiasi degli eccipienti di RHINOCORT AQUA spray nasale. Vedere la fine di questo foglio illustrativo per un elenco completo degli ingredienti di RHINOCORT AQUA (budesonide) spray nasale.
Cosa devo dire al mio medico prima di usare RHINOCORT 100mcg AQUA (budesonide) spray nasale?
Prima di usare RHINOCORT AQUA (budesonide) spray nasale, informi il medico o il farmacista se:
- sono stati recentemente in giro con qualcuno con la varicella o il morbillo
- ha problemi al fegato
- avere infezioni non trattate
- ha mai avuto un'infezione chiamata tubercolosi
- avere un'infezione agli occhi
- ha subito di recente un intervento chirurgico o una lesione al naso
- avere altre condizioni mediche
- sono incinta o stanno pianificando una gravidanza. Non è noto se RHINOCORT 100mcg AQUA (budesonide) spray nasale danneggerà il feto. Si rivolga al medico se è incinta o sta pianificando una gravidanza.
- stanno allattando o pianificano di allattare. RHINOCORT 100mcg AQUA (budesonide) Spray nasale può passare nel latte materno. Parlate con il vostro medico del modo migliore per nutrire il vostro bambino se prendete RHINOCORT AQUA (budesonide) spray nasale.
Informa il tuo medico di tutti i medicinali che prendi, compresi medicinali soggetti a prescrizione e senza prescrizione medica, vitamine e integratori a base di erbe.
RHINOCORT AQUA (budesonide) spray nasale può influenzare il modo in cui agiscono altri medicinali e altri medicinali possono influenzare il modo in cui agisce RHINOCORT 100mcg AQUA (budesonide) spray nasale.
Conosci le medicine che prendi. Tieni con te un elenco dei tuoi medicinali da mostrare al tuo medico e al farmacista quando ricevi un nuovo medicinale.
Come dovrei usare RHINOCORT 100mcg AQUA (budesonide) spray nasale?
- RHINOCORT 100mcg AQUA (budesonide) spray nasale deve essere utilizzato solo nel naso. Non spruzzarlo negli occhi o in bocca.
- Usa RHINOCORT AQUA (budesonide) spray nasale esattamente come il tuo medico ti dice di usarlo.
- È molto importante utilizzare regolarmente RHINOCORT AQUA (budesonide) spray nasale. Non smetta di usare RHINOCORT AQUA (budesonide) spray nasale o non modifichi la dose senza parlare con il medico, anche se si sente meglio.
- Si rivolga al medico se i sintomi non migliorano dopo aver assunto RHINOCORT AQUA (budesonide) spray nasale per 2 settimane o se i sintomi peggiorano.
- Un adulto dovrebbe aiutare un bambino a usare questo medicinale.
- Vedere le Istruzioni per l'uso per il paziente alla fine di questo foglio illustrativo per informazioni complete su come utilizzare RHINOCORT AQUA (budesonide) spray nasale.
Quali sono i possibili effetti collaterali di RHINOCORT AQUA (budesonide) spray nasale?
RHINOCORT 100mcg AQUA (budesonide) Spray nasale può causare gravi effetti collaterali tra cui:
- foro nella cartilagine all'interno del naso (perforazione del setto nasale). Informa il tuo medico se senti un fischio dal naso quando respiri.
- lenta guarigione delle ferite. Non dovresti usare RHINOCORT 100mcg AQUA (budesonide) spray nasale fino a quando il tuo naso non è guarito se hai una ferita al naso, se hai subito un intervento chirurgico al naso o se il tuo naso è stato ferito.
- infezione fungina nel naso.
- reazioni allergiche. Informi il medico o richieda immediatamente assistenza medica se si dispone di:
- eruzione cutanea, arrossamento o gonfiore
- forte prurito
- gonfiore del viso, della bocca e della lingua
- problemi del sistema immunitario che possono aumentare il rischio di infezioni. Hai maggiori probabilità di contrarre infezioni se assumi medicinali che indeboliscono la capacità del tuo corpo di combattere le infezioni. Evitare il contatto con persone che hanno malattie contagiose come la varicella o il morbillo durante l'utilizzo di RHINOCORT AQUA (budesonide) spray nasale. I sintomi dell'infezione possono includere febbre, dolore, dolori, brividi, sensazione di stanchezza, nausea e vomito.
- insufficienza surrenalica, L'insufficienza surrenalica è una condizione in cui le ghiandole surrenali non producono abbastanza ormoni steroidei. I sintomi dell'insufficienza surrenalica possono includere stanchezza, debolezza, nausea, vomito e pressione sanguigna bassa.
- crescita rallentata o ritardata nei bambini. La crescita di un bambino deve essere controllata regolarmente durante l'utilizzo di RHINOCORT 100mcg AQUA (budesonide) spray nasale.
- problemi agli occhi, come glaucoma e cataratta. Informi il medico se ha un cambiamento nella vista o ha una storia di aumento della pressione intraoculare, glaucoma e/o cataratta.
Chiama il tuo medico o chiedi immediatamente assistenza medica se hai i sintomi di uno qualsiasi dei gravi effetti collaterali sopra elencati.
Gli effetti collaterali più comuni di RHINOCORT 100mcg AQUA (budesonide) spray nasale includono:
- sangue dal naso
- mal di gola
- difficoltà respiratorie come respiro sibilante o irrigidimento del torace
- tosse
- irritazione del naso
Informa il tuo medico se hai qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di RHINOCORT 100mcg AQUA (budesonide) spray nasale. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiama il tuo medico per un consiglio medico sugli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA all'indirizzo 1-800-FDA-1088 o www.fda.gov/medwatch.
È possibile segnalare gli effetti collaterali ad AstraZeneca al numero 1-800-236-9933.
Cosa dovrei sapere sulla rinite allergica?
"rinite" significa infiammazione del rivestimento del naso. A volte è chiamato "febbre da fieno". La rinite allergica può essere causata da allergie a pollini, peli di animali, acari della polvere domestica e spore di muffe. Se hai la rinite allergica, il naso diventa chiuso, che cola e prude. Potresti anche starnutire molto. Potresti avere occhi rossi, pruriginosi e acquosi; prurito alla gola; o orecchie ostruite e pruriginose.
RHINOCORT AQUA (budesonide) spray nasale aiuta ad alleviare i sintomi nasali.
Se hai anche prurito agli occhi che lacrimano, dovresti dirlo al tuo medico. Lui o lei può prescrivere farmaci aggiuntivi per trattare questi sintomi.
Come devo conservare RHINOCORT AQUA (budesonide) spray nasale?
- Conservare RHINOCORT AQUA (budesonide) spray nasale a una temperatura compresa tra 68°F e 77°F (da 20°C a 25°C).
- Non congelare RHINOCORT AQUA (budesonide) spray nasale.
- Proteggere dalla luce lo spray nasale RHINOCORT 100mcg AQUA (budesonide).
- Non utilizzare RHINOCORT 100mcg AQUA (budesonide) spray nasale dopo che è stato utilizzato il numero di spray indicato sull'etichetta (non include l'adescamento) o dopo la data di scadenza indicata sull'etichetta della confezione o del flacone.
- Conservare il cappuccio protettivo verde sullo spray nasale RHINOCORT AQUA (budesonide) quando non è in uso. (Perfavore guarda Prima dell'uso sul retro ).
- Tenere RHINOCORT 100mcg AQUA (budesonide) spray nasale e tutti i farmaci fuori dalla portata dei bambini.
Informazioni generali sull'uso sicuro ed efficace di RHINOCORT AQUA (budesonide) spray nasale:
Non utilizzare RHINOCORT 100mcg AQUA (budesonide) spray nasale per una condizione per la quale non è stato prescritto. Non somministrare RHINOCORT AQUA (budesonide) spray nasale ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Questo foglio illustrativo per il paziente riassume le informazioni più importanti su RHINOCORT 100mcg AQUA (budesonide) spray nasale. Se desideri maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo farmacista o operatore sanitario informazioni su RHINOCORT 100mcg AQUA (budesonide) spray nasale scritto per gli operatori sanitari.
Per ulteriori informazioni, visitare www.astrazeneca-us.com o chiamare AstraZeneca al numero 1-800-236-9933.
Quali sono gli ingredienti dello spray nasale RHINOCORT AQUA (budesonide)?
Principio attivo: budesonide
Ingredienti inattivi: Cellulosa microcristallina e carbossimetilcellulosa sodica, destrosio anidro, polisorbato 80, disodio edetato, potassio sorbato e acqua purificata e acido cloridrico.
Istruzioni per l'uso per il paziente
Da usare solo nel naso. Non spruzzare negli occhi o in bocca.
Leggere attentamente le istruzioni per l'uso per il paziente prima di iniziare a usare RHINOCORT 100mcg AQUA (budesonide) spray nasale. In caso di domande, chiedi al tuo medico
Figura A 
Come preparare lo spray nasale RHINOCORT AQUA (budesonide).
Prima di usare RHINOCORT AQUA (budesonide) spray nasale, il flacone deve essere adescato. Per preparare RHINOCORT 100mcg AQUA (budesonide) Spray nasale:
1. Tirare per rimuovere il cappuccio protettivo verde dall'unità spray nasale.
2. Agitare delicatamente il flacone per alcuni secondi prima di ogni utilizzo.
3. Tenere saldamente il flacone, come mostrato nella Figura B, con l'indice e il medio su entrambi i lati dell'ugello e il pollice sotto il flacone.
Figura B 
4. Attivare la pompa premendo rapidamente e con decisione sul collare bianco tenendo la base del flacone con il pollice.
5. Prima del primo utilizzo di RHINOCORT AQUA (budesonide) spray nasale, agitare delicatamente il flacone. La pompa deve essere adescata premendo 8 volte sul collare bianco. La pompa è ora pronta per l'uso. Se utilizzata quotidianamente, la pompa non ha bisogno di essere ricaricata. Se non viene utilizzato per 2 giorni di seguito, ricaricare con 1 spruzzo o fino a quando non appare uno spruzzo fine. Se non utilizzato per più di 14 giorni, risciacquare l'ugello della pompa utilizzando i passaggi di pulizia elencati alla fine di questo foglio illustrativo. Dopo la pulizia, riadescare con 2 spruzzi o fino a quando non appare uno spruzzo fine.
Ogni flacone di RHINOCORT AQUA (budesonide) spray nasale contiene medicinale sufficiente per spruzzare il medicinale dal flacone 120 volte dopo che il flacone è stato adescato.
Non dovresti usare il flacone di RHINOCORT 100mcg AQUA (budesonide) spray nasale dopo 120 spruzzi. Ulteriori spray dopo 120 potrebbero non contenere la giusta quantità di medicinale. Dovresti tenere traccia del numero di spray che usi da ogni flacone di RHINOCORT 100mcg AQUA spray nasale e gettare via qualsiasi medicinale residuo che potrebbe essere rimasto nel flacone. Ricarica la tua prescrizione mensilmente.
Come usare lo spray nasale RHINOCORT 100mcg AQUA (budesonide).
Segui queste istruzioni per l'uso quotidiano di RHINOCORT AQUA (budesonide) spray nasale:
Figura C 
4. Inserisci la punta dello spray nella narice (la punta non deve arrivare molto nel naso). Chiudi l'altra narice con un dito e inclina leggermente la testa in avanti in modo che lo spray miri verso la parte posteriore del naso (vedi Figura D ).
Figura D 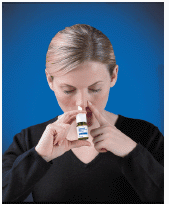
5. Per ogni nebulizzazione, azionare la pompa premendo velocemente e con decisione sul collare bianco tenendo la base del flacone con il pollice. Respira delicatamente verso l'interno attraverso la narice.
6. Dopo aver spruzzato nella narice, inclinare la testa all'indietro per alcuni secondi (vedi Figura E ).
Figura E 
7. Se è necessario un secondo spruzzo nella stessa narice, ripetere i passaggi da 3 a 6.
8. Ripetere i passaggi da 3 a 7 per l'altra narice.
9. Evitare di soffiarsi il naso per 15 minuti dopo aver usato RHINOCORT 100mcg AQUA (budesonide) spray nasale.
10. Pulire l'ugello di spruzzatura con un panno pulito (vedere Figura F ), e sostituire il cappuccio protettivo verde. Conservare la bottiglia in posizione verticale.
Figura F 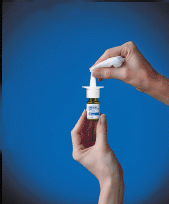
Come pulire lo spray nasale RHINOCORT 100mcg AQUA (budesonide).
Figura G 
Sciacquare regolarmente il cappuccio protettivo verde e l'ugello di nebulizzazione. Per farlo:
Per ulteriori informazioni su RHINOCORT 100mcg AQUA (budesonide) ® spray nasale, chiamare l'AstraZeneca Information Center, dal lunedì al venerdì, dalle 8:00 alle 18:00 ET, esclusi i giorni festivi a 1-800-236-9933.
