Naprosyn 250mg, 500mg Naproxen Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Naprosyn 500mg e come si usa?
Naprosyn 250 mg è un medicinale da prescrizione usato per trattare i sintomi del dolore o dell'infiammazione causati da artrite, spondilite anchilosante, tendinite, borsite, gotta o crampi mestruali. Naprosyn può essere usato da solo o con altri farmaci.
Naprosyn 250 mg è un farmaco antinfiammatorio non steroideo (FANS).
Non è noto se Naprosyn sia sicuro ed efficace nei bambini di età inferiore ai 2 anni.
Quali sono i possibili effetti collaterali di Naprosyn?
Naprosyn può causare gravi effetti collaterali tra cui:
- fiato corto,
- gonfiore o rapido aumento di peso,
- eruzioni cutanee o vesciche,
- feci sanguinolente o catramose,
- tossendo sangue o vomito che sembrano fondi di caffè,
- nausea,
- mal di pancia superiore,
- perdita di appetito,
- urina scura,
- sgabelli color argilla,
- ingiallimento della pelle o degli occhi (ittero),
- minzione scarsa o assente,
- minzione dolorosa,
- gonfiore ai piedi o alle caviglie,
- anemia (globuli rossi bassi),
- pelle pallida,
- stanchezza,
- sentirsi stordito, e
- mani o piedi freddi
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Naprosyn includono:
- male alla testa,
- indigestione,
- bruciore di stomaco, e
- sintomi influenzali
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Naprosyn. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
AVVERTIMENTO
RISCHIO DI GRAVI EVENTI CARDIOVASCOLARI E GASTROINTESTINALI
Eventi trombotici cardiovascolari
- I farmaci antinfiammatori non steroidei (FANS) causano un aumento del rischio di gravi eventi trombotici cardiovascolari, inclusi infarto del miocardio e ictus, che possono essere fatali. Questo rischio può verificarsi all'inizio del trattamento e può aumentare con la durata dell'uso [vedere AVVERTENZE E PRECAUZIONI].
- NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS sono controindicati nel contesto di un intervento chirurgico di bypass coronarico (CABG) [vedi CONTROINDICAZIONI, AVVERTENZE E PRECAUZIONI].
Sanguinamento gastrointestinale, ulcera e perforazione
- FANS causano un aumentato rischio di gravi eventi avversi gastrointestinali (GI), inclusi sanguinamento, ulcerazione e perforazione dello stomaco o dell'intestino, che possono essere fatali. Questi eventi possono verificarsi in qualsiasi momento durante l'uso e senza sintomi di avviso. Pazienti anziani e pazienti con una precedente storia di ulcera peptica e/o sanguinamento gastrointestinale sono a maggior rischio di eventi gastrointestinali gravi [vedere AVVERTENZE E PRECAUZIONI].
DESCRIZIONE
NAPROSYN (naprossene) compresse, EC-NAPROSYN (naprossene) compresse a rilascio ritardato e ANAPROX DS (naprossene sodico) compresse sono farmaci antinfiammatori non steroidei disponibili come segue: NAPROSYN 250 mg compresse sono disponibili come compresse gialle contenenti 500 mg di naprossene per somministrazione orale .
EC-NAPROSYN compresse a rilascio ritardato sono disponibili sotto forma di compresse bianche a rivestimento enterico contenenti 375 mg di naprossene o 500 mg di naprossene per somministrazione orale.
Le compresse di ANAPROX DS sono disponibili sotto forma di compresse blu scuro contenenti 550 mg di naprossene sodico per somministrazione orale.
Il naprossene è un derivato dell'acido propionico correlato al gruppo dell'acido arilacetico dei farmaci antinfiammatori non steroidei. I nomi chimici del naprossene e del naprossene sodico sono rispettivamente acido (S)-6-metossi-α-metil-2-naftaleneacetico e acido (S)-6metossi-α-metil-2-naftaleneacetico, sale di sodio. Il naprossene ha un peso molecolare di 230,26 e una formula molecolare di C14H14O3. Il naprossene sodico ha un peso molecolare di 252,23 e una formula molecolare di C14H13NaO3. Il naprossene e il naprossene sodico hanno rispettivamente le seguenti strutture:
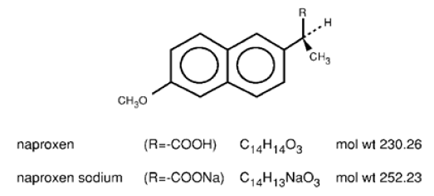
Il naprossene è una sostanza cristallina inodore, di colore da bianco a biancastro. È liposolubile, praticamente insolubile in acqua a basso pH e liberamente solubile in acqua a pH elevato. Il coefficiente di ripartizione ottanolo/acqua del naprossene a pH 7,4 è compreso tra 1,6 e 1,8. Il naprossene sodico è un solido cristallino da bianco a bianco crema, liberamente solubile in acqua a pH neutro.
Gli ingredienti inattivi nelle compresse di NAPROSYN 250 mg includono: croscarmellosa sodica, ossidi di ferro, povidone e magnesio stearato.
Gli ingredienti inattivi delle compresse a rilascio ritardato EC-NAPROSYN includono: croscarmellosa sodica, povidone e magnesio stearato. La dispersione del rivestimento enterico contiene copolimero di acido metacrilico, talco, trietil citrato, idrossido di sodio e acqua purificata. L'impronta sulle compresse è di inchiostro nero. La dissoluzione di questa compressa di naprossene con rivestimento enterico dipende dal pH con una rapida dissoluzione al di sopra di pH 6. Non vi è dissoluzione al di sotto di pH 4.
Gli ingredienti inattivi nelle compresse di ANAPROX DS includono: magnesio stearato, cellulosa microcristallina, povidone e talco. La sospensione di rivestimento può contenere idrossipropilmetilcellulosa 2910, Opaspray K-1-4227, polietilenglicole 8000 o Opadry YS-1-4216.
INDICAZIONI
NAPROSYN 500 mg compresse, EC-NAPROSYN 250 mg e ANAPROX DS sono indicati per:
il sollievo dei segni e sintomi di:
- artrite reumatoide
- osteoartrite
- spondilite anchilosante
- Artrite idiopatica giovanile poliarticolare
NAPROSYN compresse e ANAPROX DS sono indicati anche per:
il sollievo di segni e sintomi di:
- tendinite
- borsite
- gotta acuta
la gestione di:
- dolore
- dismenorrea primaria
DOSAGGIO E SOMMINISTRAZIONE
Istruzioni generali per il dosaggio
Considerare attentamente i potenziali benefici e rischi di NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS e altre opzioni di trattamento prima di decidere di utilizzare NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg e ANAPROX DS. Utilizzare la dose efficace più bassa per la durata più breve coerente con gli obiettivi di trattamento del singolo paziente [vedi AVVERTENZE E PRECAUZIONI ].
Dopo aver osservato la risposta alla terapia iniziale con NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg o ANAPROX DS, la dose e la frequenza devono essere adeguate alle esigenze del singolo paziente.
Per mantenere l'integrità del rivestimento enterico, la compressa EC-NAPROSYN non deve essere rotta, frantumata o masticata durante l'ingestione.
prodotti contenenti naprossene come NAPROSYN 500 mg, EC-NAPROSYN 250 mg e ANAPROX DS e altri prodotti a base di naprossene non devono essere usati contemporaneamente poiché circolano tutti nel plasma come anione naprossene.
Artrite reumatoide, artrosi e spondilite anchilosante
I dosaggi raccomandati di NAPROSYN 500 mg compresse, ANAPROX DS e EC-NAPROSYN 250 mg sono mostrati nella Tabella 1.
Durante la somministrazione a lungo termine, la dose di naprossene può essere aumentata o ridotta a seconda della risposta clinica del paziente. Una dose giornaliera inferiore può essere sufficiente per la somministrazione a lungo termine.
Le dosi mattutine e serali non devono necessariamente essere uguali in termini di dimensioni e la somministrazione del farmaco più frequentemente di due volte al giorno generalmente non fa differenza nella risposta.
Nei pazienti che tollerano bene dosi più basse, la dose può essere aumentata a 1500 mg/die di naprossene per periodi limitati fino a 6 mesi quando è richiesto un livello più elevato di attività antinfiammatoria/analgesica. Durante il trattamento di tali pazienti con naprossene 1500 mg/die, il medico deve osservare un aumento sufficiente dei benefici clinici per compensare il potenziale aumento del rischio.
Artrite idiopatica giovanile poliarticolare
Le forme di dosaggio solido-orale di naprossene potrebbero non consentire la titolazione flessibile della dose necessaria nei pazienti pediatrici con artrite idiopatica giovanile poliarticolare. Una formulazione liquida può essere più appropriata per il dosaggio basato sul peso e per la necessità di flessibilità della dose nei bambini.
Nei pazienti pediatrici, dosi di 5 mg/kg/die hanno prodotto livelli plasmatici di naprossene simili a quelli osservati negli adulti che assumevano 500 mg di naprossene [vedere FARMACOLOGIA CLINICA ]. La dose giornaliera totale raccomandata di naprossene è di circa 10 mg/kg, suddivisa in 2 dosi. La somministrazione di NAPROSYN compresse non è appropriata per i bambini di peso inferiore a 50 chilogrammi.
Gestione del dolore, della dismenorrea primaria e della tendinite e borsite acuta
La dose iniziale raccomandata di ANAPROX DS (naprossene sodico) compresse è di 550 mg, seguita da 550 mg ogni 12 ore o 275 mg (metà di una compressa da 550 mg) ogni 6-8 ore secondo necessità. La dose giornaliera totale iniziale non deve superare 1375 mg (due compresse e mezzo) di naprossene sodico. Successivamente, la dose giornaliera totale non deve superare i 1100 mg di naprossene sodico. Poiché il sale sodico del naprossene viene assorbito più rapidamente, ANAPROX DS è raccomandato per la gestione di condizioni dolorose acute quando si desidera una pronta insorgenza di sollievo dal dolore. Si possono anche usare NAPROSYN compresse. La dose iniziale raccomandata di NAPROSYN compresse è di 500 mg seguita da 250 mg (metà di una compressa di NAPROSYN da 500 mg) ogni 6-8 ore secondo necessità. La dose giornaliera totale non deve superare i 1250 mg di naprossene.
EC-NAPROSYN 250 mg non è raccomandato per il trattamento iniziale del dolore acuto perché l'assorbimento del naprossene è ritardato rispetto ad altri prodotti contenenti naprossene [vedi FARMACOLOGIA CLINICA ].
Gotta acuta
La dose iniziale raccomandata è 750 mg (una compressa e mezza) di NAPROSYN 250 mg compresse seguita da 250 mg (mezza compressa) ogni 8 ore fino alla scomparsa dell'attacco. ANAPROX DS può essere utilizzato anche a una dose iniziale di 825 mg (una compressa e mezza) seguita da 275 mg (mezza compressa) ogni 8 ore. EC-NAPROSYN non è raccomandato a causa del ritardo nell'assorbimento.
Non intercambiabilità con altre formulazioni di naprossene
Dosi e formulazioni diverse (p. es., compresse, sospensione) di naprossene non sono intercambiabili. Questa differenza dovrebbe essere presa in considerazione quando si cambiano i punti di forza o le formulazioni.
COME FORNITO
Forme di dosaggio e punti di forza
Compresse di NAPROSYN® (naprossene): 500 mg: gialle, a forma di capsula, con inciso NPR LE 500 su un lato e inciso sull'altro.
EC-NAPROSYN® (naprossene) compresse a rilascio ritardato: 375 mg: compresse bianche, ovali, biconvesse, con impresso NPR EC 375 su un lato.
EC-NAPROSYN® (naprossene) compresse a rilascio ritardato: 500 mg: compresse bianche a rivestimento oblungo con impresso NPR EC 500 su un lato.
ANAPROX® DS (naprossene sodico) compresse: 550 mg: blu scuro, di forma oblunga, con inciso NPS 550 su un lato e inciso su entrambi i lati.
Stoccaggio e manipolazione
NAPROSYN (naprossene) compresse 500 mg : compresse gialle a forma di capsula, con impresso NPR LE 500 su un lato e inciso sull'altro. Confezionato in flaconi da 100 resistenti alla luce. Fornito come:
NDC 69437-316-01 100 (bottiglia)
Conservare a una temperatura compresa tra 15°C e 30°C (da 59°F a 86°F) in contenitori ben chiusi; dispensare in contenitori resistenti alla luce.
EC-NAPROSYN (naprossene) compresse a rilascio ritardato 375 mg : compresse rivestite bianche, ovali, biconvesse, con impresso NPR EC 375 su un lato. Confezionato in flaconi da 100 resistenti alla luce. Fornito come:
NDC 69437-415-01 100 (bottiglia)
500 mg compresse bianche, con rivestimento oblungo, con impresso NPR EC 500 su un lato. Confezionato in flaconi da 100 resistenti alla luce. Fornito come:
NDC 69437-416-01 100 (bottiglia)
Conservare a una temperatura compresa tra 15°C e 30°C (da 59°F a 86°F) in contenitori ben chiusi; dispensare in contenitori resistenti alla luce.
ANAPROX DS (naprossene sodico) Compresse 550 mg : compresse di colore blu scuro, di forma oblunga, con inciso NPS 550 su un lato e incise su entrambi i lati. Confezionato in bottiglie da 100. Fornito come:
NDC 69437-203-01 100 (bottiglia)
Conservare a una temperatura compresa tra 15° e 30°C (da 59° a 86°F) in contenitori ben chiusi.
Prodotto per: Â Atnahs Pharma, Miles Grey Road, Basildon, Essex, SS14 3FR, Regno Unito. Distribuito da: Canton Laboratories, LLC., Alpharetta, GA 30004-5945, Stati Uniti. Revisionato: aprile 2021
EFFETTI COLLATERALI
Le seguenti reazioni avverse sono discusse in modo più dettagliato in altre sezioni dell'etichettatura:
- Eventi trombotici cardiovascolari [vedi AVVERTENZE E PRECAUZIONI ]
- Sanguinamento gastrointestinale, ulcerazione e perforazione [vedi AVVERTENZE E PRECAUZIONI ]
- Epatotossicità [vedi AVVERTENZE E PRECAUZIONI ]
- Ipertensione [vedi AVVERTENZE E PRECAUZIONI ]
- Insufficienza cardiaca ed edema [vedi AVVERTENZE E PRECAUZIONI ]
- Tossicità renale e iperkaliemia [vedi AVVERTENZE E PRECAUZIONI ]
- Reazioni anafilattiche [vedi AVVERTENZE E PRECAUZIONI ]
- Reazioni cutanee gravi [vedi AVVERTENZE E PRECAUZIONI ]
- Tossicità ematologica [vedi AVVERTENZE E PRECAUZIONI ]
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
Le reazioni avverse riportate in studi clinici controllati in 960 pazienti trattati per l'artrite reumatoide o l'osteoartrite sono elencate di seguito. In generale, le reazioni nei pazienti trattati cronicamente sono state riportate da 2 a 10 volte più frequentemente rispetto a studi a breve termine su 962 pazienti trattati per dolore da lieve a moderato o per dismenorrea. I disturbi più frequenti segnalati riguardavano il tratto gastrointestinale.
Uno studio clinico ha rilevato che le reazioni gastrointestinali sono più frequenti e più gravi nei pazienti con artrite reumatoide che assumevano dosi giornaliere di 1500 mg di naprossene rispetto a quelli che assumevano 750 mg di naprossene.
In studi clinici controllati con circa 80 pazienti pediatrici e in studi in aperto ben monitorati con circa 400 pazienti pediatrici affetti da artrite idiopatica giovanile poliarticolare trattati con naprossene, l'incidenza di rash e tempi di sanguinamento prolungati è stata maggiore, l'incidenza di le reazioni del sistema nervoso erano più o meno le stesse e l'incidenza di altre reazioni era inferiore nei pazienti pediatrici rispetto agli adulti.
Nei pazienti che assumevano naprossene negli studi clinici, le esperienze avverse riportate più frequentemente in circa l'1-10% dei pazienti sono state:
Esperienze gastrointestinali (GI), tra cui: bruciore di stomaco*, dolore addominale*, nausea*, costipazione*, diarrea, dispepsia, stomatite
Sistema nervoso centrale: mal di testa*, vertigini*, sonnolenza*, stordimento, vertigini
dermatologico: prurito (prurito)*, eruzioni cutanee*, ecchimosi*, sudorazione, porpora
Sensi speciali: tinnito*, disturbi visivi, disturbi dell'udito
Cardiovascolare: edema*, palpitazioni
Generale: dispnea*, sete
*Incidenza della reazione riportata tra il 3% e il 9%. Quelle reazioni che si verificano in meno del 3% dei pazienti non sono marcate.
Nei pazienti che assumevano FANS, sono state riportate anche le seguenti esperienze avverse in circa l'1-10% dei pazienti.
Esperienze gastrointestinali (GI), tra cui: flatulenza, sanguinamento/perforazione macroscopica, ulcere gastrointestinali (gastrico/duodenale), vomito
Generale: funzionalità renale anormale, anemia, aumento degli enzimi epatici, aumento del tempo di sanguinamento, eruzioni cutanee
Le seguenti sono ulteriori esperienze avverse riportate in
Gastrointestinale: pancreatite, vomito
Epatobiliare: ittero
Emico e linfatico: melena, trombocitopenia, agranulocitosi
Sistema nervoso: incapacità di concentrazione
dermatologico: eruzioni cutanee
Esperienza di post marketing
Le seguenti reazioni avverse sono state identificate durante l'uso successivo all'approvazione del naprossene. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco.
Le seguenti sono ulteriori esperienze avverse segnalate in
Corpo nel suo insieme: reazioni anafilattoidi, edema angioneurotico, disturbi mestruali, piressia (brividi e febbre)
Cardiovascolare: insufficienza cardiaca congestizia, vasculite, ipertensione, edema polmonare
Gastrointestinale: infiammazione, sanguinamento (talvolta fatale, in particolare negli anziani), ulcerazione, perforazione e ostruzione del tratto gastrointestinale superiore o inferiore. Esofagite, stomatite, ematemesi, colite, esacerbazione di malattie infiammatorie intestinali (colite ulcerosa, morbo di Crohn).
Epatobiliare: test di funzionalità epatica anormali, epatite (alcuni casi sono stati fatali)
Emico e linfatico: eosinofilia, leucopenia, granulocitopenia, anemia emolitica, anemia aplastica
Metabolici e Nutrizionali: iperglicemia, ipoglicemia
Sistema nervoso: depressione, anomalie dei sogni, insonnia, malessere, mialgia, debolezza muscolare, meningite asettica, disfunzione cognitiva, convulsioni
Respiratorio: polmonite eosinofila, asma
dermatologico: alopecia, orticaria, necrolisi epidermica tossica, eritema multiforme, eritema nodoso, eruzione fissa da farmaco, lichen planus, reazione pustolosa, lupus eritematosi sistemico, reazioni bollose, inclusa la sindrome di Stevens-Johnson, dermatite fotosensibile, reazioni di fotosensibilità, inclusi rari casi simili alla porfiria cutanea tarda (pseudoporfiria) o epidermolisi bollosa. Se si verificano fragilità cutanea, vesciche o altri sintomi indicativi di pseudoporfiria, il trattamento deve essere interrotto e il paziente deve essere monitorato.
Sensi speciali: ipoacusia, opacità corneale, papillite, neurite ottica retrobulbare, papilledema
Urogenitale: nefrite glomerulare, ematuria, iperkaliemia, nefrite interstiziale, sindrome nefrosica, malattia renale, insufficienza renale, necrosi papillare renale, aumento della creatinina sierica
Riproduzione (femmina): infertilità
Nei pazienti che assumevano FANS, sono state riportate anche le seguenti reazioni avverse in
Corpo nel suo insieme: febbre, infezioni, sepsi, reazioni anafilattiche, alterazioni dell'appetito, morte
Cardiovascolare: ipertensione, tachicardia, sincope, aritmia, ipotensione, infarto del miocardio
Gastrointestinale: secchezza delle fauci, esofagite, ulcere gastriche/peptiche, gastrite, glossite, eruttazione
Epatobiliare: epatite, insufficienza epatica
Emico e linfatico: sanguinamento rettale, linfoadenopatia, pancitopenia
Metabolici e Nutrizionali: variazioni di peso
Sistema nervoso: ansia, astenia, confusione, nervosismo, parestesia, sonnolenza, tremori, convulsioni, coma, allucinazioni
Respiratorio: asma, depressione respiratoria, polmonite
dermatologico: dermatite esfoliativa
Sensi speciali: visione offuscata, congiuntivite
Urogenitale: cistite, disuria, oliguria/poliuria, proteinuria
INTERAZIONI DI DROGA
Vedere la tabella 1 per le interazioni farmacologiche clinicamente significative con naprossene.
Interazioni farmacologiche/test di laboratorio
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Eventi trombotici cardiovascolari
Studi clinici su diversi FANS COX-2 selettivi e non selettivi della durata fino a tre anni hanno mostrato un aumento del rischio di gravi eventi trombotici cardiovascolari (CV), inclusi infarto del miocardio (IM) e ictus, che possono essere fatali. Sulla base dei dati disponibili, non è chiaro se il rischio di eventi trombotici CV sia simile per tutti i FANS. L'aumento relativo degli eventi trombotici CV gravi rispetto al basale conferito dall'uso di FANS sembra essere simile in quelli con e senza malattia CV nota o fattori di rischio per malattia CV. Tuttavia, i pazienti con malattia CV nota o fattori di rischio avevano un'incidenza assoluta più elevata di eventi trombotici CV gravi in eccesso, a causa del loro tasso basale aumentato. Alcuni studi osservazionali hanno rilevato che questo aumento del rischio di gravi eventi trombotici CV è iniziato già nelle prime settimane di trattamento. L'aumento del rischio trombotico CV è stato osservato in modo più coerente a dosi più elevate.
Per ridurre al minimo il potenziale rischio di un evento CV avverso nei pazienti trattati con FANS, utilizzare la dose efficace più bassa per la durata più breve possibile. Medici e pazienti devono rimanere vigili per lo sviluppo di tali eventi, durante l'intero ciclo di trattamento, anche in assenza di precedenti sintomi CV. I pazienti devono essere informati dei sintomi di eventi CV gravi e delle misure da intraprendere se si verificano.
Non ci sono prove coerenti che l'uso concomitante di aspirina mitighi l'aumento del rischio di gravi eventi trombotici CV associati all'uso di FANS. L'uso concomitante di aspirina e un FANS, come il naprossene, aumenta il rischio di gravi eventi gastrointestinali (GI).
Stato post chirurgia dell'innesto di bypass dell'arteria coronaria (CABG).
Due ampi studi clinici controllati su un FANS selettivo COX-2 per il trattamento del dolore nei primi 10-14 giorni dopo l'intervento chirurgico CABG hanno riscontrato un'aumentata incidenza di infarto del miocardio e ictus. I FANS sono controindicati nel contesto del CABG [vedi CONTROINDICAZIONI ].
Pazienti post-infarto miocardico
Studi osservazionali condotti nel registro nazionale danese hanno dimostrato che i pazienti trattati con FANS nel periodo successivo all'infarto del miocardio presentavano un rischio aumentato di reinfarto, morte correlata a CV e mortalità per tutte le cause a partire dalla prima settimana di trattamento. In questa stessa coorte, l'incidenza di decessi nel primo anno dopo l'infarto miocardico è stata di 20 per 100 anni-persona nei pazienti trattati con FANS rispetto a 12 per 100 anni-persona nei pazienti non esposti ai FANS. Sebbene il tasso assoluto di morte sia leggermente diminuito dopo il primo anno dopo l'infarto del miocardio, l'aumento del rischio relativo di morte nelle utilizzatrici di FANS è persistito almeno nei successivi quattro anni di follow-up.
Evitare l'uso di NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS in pazienti con infarto miocardico recente a meno che non si preveda che i benefici superino il rischio di eventi trombotici CV ricorrenti. Se NAPROSYN 250 mg compresse, EC-NAPROSYN e ANAPROX DS vengono utilizzati in pazienti con infarto miocardico recente, monitorare i pazienti per segni di ischemia cardiaca.
Sanguinamento gastrointestinale, ulcera e perforazione
FANS, incluso il naprossene, causano gravi eventi avversi gastrointestinali (GI) tra cui infiammazione, sanguinamento, ulcerazione e perforazione dell'esofago, dello stomaco, dell'intestino tenue o dell'intestino crasso, che possono essere fatali. Questi gravi eventi avversi possono verificarsi in qualsiasi momento, con o senza sintomi premonitori, nei pazienti trattati con FANS.
Solo un paziente su cinque che sviluppa un evento avverso grave del tratto gastrointestinale superiore durante la terapia con FANS è sintomatico. Ulcere del tratto gastrointestinale superiore, emorragie evidenti o perforazioni causate da FANS si sono verificate in circa l'1% dei pazienti trattati per 3-6 mesi e in circa il 2%-4% dei pazienti trattati per un anno. Tuttavia, anche la terapia a breve termine con FANS non è priva di rischi.
Fattori di rischio per sanguinamento, ulcerazione e perforazione gastrointestinale
I pazienti con una precedente storia di ulcera peptica e/o emorragia gastrointestinale che usavano FANS avevano un rischio maggiore di 10 volte di sviluppare un'emorragia gastrointestinale rispetto ai pazienti senza questi fattori di rischio. Altri fattori che aumentano il rischio di sanguinamento gastrointestinale nei pazienti trattati con FANS includono una maggiore durata della terapia con FANS; uso concomitante di corticosteroidi orali, aspirina, anticoagulanti o inibitori selettivi della ricaptazione della serotonina (SSRI); fumare; uso di alcol; età avanzata; e scarso stato di salute generale. La maggior parte delle segnalazioni post-marketing di eventi gastrointestinali fatali si sono verificate in pazienti anziani o debilitati. Inoltre, i pazienti con malattia epatica avanzata e/o coagulopatia sono ad aumentato rischio di sanguinamento gastrointestinale.
Strategie per ridurre al minimo i rischi gastrointestinali nei pazienti trattati con FANS
- Utilizzare il dosaggio efficace più basso per la durata più breve possibile.
- Evitare la somministrazione di più di un FANS alla volta.
- Evitare l'uso in pazienti a rischio più elevato a meno che non si preveda che i benefici superino l'aumento del rischio di sanguinamento. Per tali pazienti, così come per quelli con sanguinamento gastrointestinale attivo, considerare terapie alternative diverse dai FANS.
- Prestare attenzione a segni e sintomi di ulcerazione e sanguinamento gastrointestinale durante la terapia con FANS.
- Se si sospetta un evento avverso gastrointestinale grave, avviare tempestivamente la valutazione e il trattamento e interrompere NAPROSYN compresse, EC-NAPROSYN o ANAPROX DS fino a quando non viene escluso un evento avverso gastrointestinale grave.
- Nel contesto dell'uso concomitante di basse dosi di aspirina per la profilassi cardiaca, monitorare più da vicino i pazienti per l'evidenza di sanguinamento gastrointestinale [vedi INTERAZIONI DI DROGA ].
Epatotossicità
Negli studi clinici sono stati riportati aumenti di ALT o AST (tre o più volte il limite superiore della norma [ULN]) in circa l'1% dei pazienti trattati con FANS. Inoltre, sono stati segnalati casi rari, talvolta fatali, di grave danno epatico, tra cui epatite fulminante, necrosi epatica e insufficienza epatica.
Aumenti di ALT o AST (meno di tre volte l'ULN) possono verificarsi fino al 15% dei pazienti trattati con FANS, incluso il naprossene.
Informare i pazienti dei segnali di allarme e dei sintomi di epatotossicità (p. es., nausea, affaticamento, letargia, diarrea, prurito, ittero, dolorabilità del quadrante superiore destro e sintomi "simil-influenzali"). Se si sviluppano segni e sintomi clinici coerenti con una malattia del fegato, o se si verificano manifestazioni sistemiche (p. es., eosinofilia, eruzione cutanea, ecc.), interrompere immediatamente NAPROSYN 500 mg compresse, EC-NAPROSYN 250 mg o ANAPROX DS ed eseguire una valutazione clinica del paziente .
Ipertensione
I FANS, tra cui NAPROSYN 250 mg compresse, EC-NAPROSYN e ANAPROX DS, possono portare a una nuova insorgenza di ipertensione o al peggioramento di un'ipertensione preesistente, entrambi i quali possono contribuire all'aumentata incidenza di eventi cardiovascolari. I pazienti che assumono inibitori dell'enzima di conversione dell'angiotensina (ACE), diuretici tiazidici o diuretici dell'ansa possono avere una risposta ridotta a queste terapie durante l'assunzione di FANS [vedi INTERAZIONI DI DROGA ].
Monitorare la pressione sanguigna (BP) durante l'inizio del trattamento con FANS e durante il corso della terapia.
Insufficienza cardiaca ed edema
La meta-analisi di Coxib e la tradizionale collaborazione dei FANS Trialists' degli studi randomizzati controllati ha dimostrato un aumento di circa due volte dei ricoveri per insufficienza cardiaca nei pazienti trattati con COX-2 selettivi e nei pazienti trattati con FANS non selettivi rispetto ai pazienti trattati con placebo. In uno studio del registro nazionale danese su pazienti con insufficienza cardiaca, l'uso di FANS ha aumentato il rischio di infarto miocardico, ospedalizzazione per insufficienza cardiaca e morte.
Inoltre, in alcuni pazienti trattati con FANS sono stati osservati ritenzione di liquidi ed edema. L'uso di naprossene può attenuare gli effetti CV di diversi agenti terapeutici usati per trattare queste condizioni mediche (p. es., diuretici, ACE inibitori o bloccanti del recettore dell'angiotensina [ARB]) [vedi INTERAZIONI DI DROGA ].
Evitare l'uso di NAPROSYN 250 mg compresse, EC-NAPROSYN o ANAPROX DS in pazienti con grave insufficienza cardiaca a meno che non si preveda che i benefici superino il rischio di peggioramento dell'insufficienza cardiaca. Se NAPROSYN 250 mg compresse, EC-NAPROSYN 250 mg o ANAPROX DS viene utilizzato in pazienti con grave insufficienza cardiaca, monitorare i pazienti per segni di peggioramento dell'insufficienza cardiaca.
Poiché ogni compressa di ANAPROX DS contiene 50 mg di sodio (circa 2 mEq per ogni 500 mg di naprossene), questo deve essere preso in considerazione nei pazienti il cui apporto complessivo di sodio deve essere fortemente limitato.
Tossicità renale e iperkaliemia
Tossicità renale
La somministrazione a lungo termine di FANS ha provocato necrosi papillare renale e altre lesioni renali.
Tossicità renale è stata osservata anche in pazienti in cui le prostaglandine renali hanno un ruolo compensatorio nel mantenimento della perfusione renale. In questi pazienti, la somministrazione di un FANS può causare una riduzione dose-dipendente della formazione di prostaglandine e, secondariamente, del flusso sanguigno renale, che può precipitare un evidente scompenso renale. I pazienti a maggior rischio di questa reazione sono quelli con funzionalità renale compromessa, disidratazione, ipovolemia, insufficienza cardiaca, disfunzione epatica, quelli che assumono diuretici e ACE-inibitori o ARB e gli anziani. L'interruzione della terapia con FANS è solitamente seguita dal recupero allo stato pretrattamento.
Non sono disponibili informazioni da studi clinici controllati sull'uso di NAPROSYN 500 mg compresse, EC-NAPROSYN o ANAPROX DS in pazienti con malattia renale avanzata. Gli effetti renali di NAPROSYN 500 mg compresse, EC-NAPROSYN o ANAPROX DS possono accelerare la progressione della disfunzione renale nei pazienti con malattia renale preesistente.
Stato del volume corretto nei pazienti disidratati o ipovolemici prima di iniziare NAPROSYN compresse, EC-NAPROSYN 250 mg o ANAPROX DS. Monitorare la funzionalità renale nei pazienti con insufficienza renale o epatica, insufficienza cardiaca, disidratazione o ipovolemia durante l'uso di NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS [vedere INTERAZIONI DI DROGA ]. Evitare l'uso di NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg e ANAPROX DS in pazienti con malattia renale avanzata a meno che non si preveda che i benefici superino il rischio di peggioramento della funzione renale. Se NAPROSYN 500 mg compresse, EC-NAPROSYN 500 mg o ANAPROX DS viene utilizzato in pazienti con malattia renale avanzata, monitorare i pazienti per segni di peggioramento della funzionalità renale.
Iperkaliemia
Con l'uso di FANS sono stati riportati aumenti della concentrazione sierica di potassio, inclusa l'iperkaliemia, anche in alcuni pazienti senza insufficienza renale. Nei pazienti con funzionalità renale normale, questi effetti sono stati attribuiti a uno stato di iporeninemichipoaldosteronismo.
Reazioni anafilattiche
Il naprossene è stato associato a reazioni anafilattiche in pazienti con e senza ipersensibilità nota al naprossene e in pazienti con asma sensibile all'aspirina [vedi CONTROINDICAZIONI e AVVERTENZE E PRECAUZIONI ].
Cerca un aiuto di emergenza se si verifica una reazione anafilattica.
Esacerbazione dell'asma correlata alla sensibilità all'aspirina
Una sottopopolazione di pazienti con asma può avere asma sensibile all'aspirina che può includere rinosinusite cronica complicata da polipi nasali; broncospasmo grave, potenzialmente fatale; e/o intolleranza all'aspirina e ad altri FANS.
Poiché in tali pazienti sensibili all'aspirina è stata segnalata una reattività crociata tra l'aspirina e altri FANS, NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg e ANAPROX DS sono controindicati nei pazienti con questa forma di sensibilità all'aspirina [vedi CONTROINDICAZIONI ]. Quando NAPROSYN 250 mg compresse, EC-NAPROSYN 250 mg o ANAPROX DS viene utilizzato in pazienti con asma preesistente (senza nota sensibilità all'aspirina), monitorare i pazienti per i cambiamenti nei segni e nei sintomi dell'asma.
Reazioni cutanee gravi
FANS, incluso il naprossene, possono causare gravi reazioni avverse cutanee come dermatite esfoliativa, sindrome di Stevens-Johnson (SJS) e necrolisi epidermica tossica (TEN), che possono essere fatali. Questi eventi gravi possono verificarsi senza preavviso. Informare i pazienti sui segni e sintomi di reazioni cutanee gravi e di interrompere l'uso di NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg o ANAPROX DS alla prima comparsa di eruzioni cutanee o qualsiasi altro segno di ipersensibilità. NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS sono controindicati nei pazienti con precedenti reazioni cutanee gravi ai FANS [vedi CONTROINDICAZIONI ].
Reazione farmacologica con eosinofilia e sintomi sistemici (DRESS)
La reazione al farmaco con eosinofilia e sintomi sistemici (DRESS) è stata segnalata in pazienti che assumevano FANS come NAPROSYN compresse, EC-NAPROSYN 500 mg e ANAPROX DS. Alcuni di questi eventi sono stati fatali o pericolosi per la vita. DRESS tipicamente, anche se non esclusivamente, si presenta con febbre, eruzione cutanea, linfoadenopatia e/o gonfiore facciale. Altre manifestazioni cliniche possono includere epatite, nefrite, anomalie ematologiche, miocardite o miosite. A volte i sintomi di DRESS possono assomigliare a un'infezione virale acuta. L'eosinofilia è spesso presente. Poiché questo disturbo è variabile nella sua presentazione, possono essere coinvolti altri sistemi di organi non menzionati qui. È importante notare che le prime manifestazioni di ipersensibilità, come febbre o linfoadenopatia, possono essere presenti anche se l'eruzione cutanea non è evidente. Se sono presenti tali segni o sintomi, interrompere NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS e valutare immediatamente il paziente.
Tossicità fetale
Chiusura prematura del dotto arterioso fetale
Evitare l'uso di FANS, tra cui NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS, nelle donne in gravidanza a circa 30 settimane di gestazione e successivamente. I FANS, tra cui NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS, aumentano il rischio di chiusura prematura del dotto arterioso fetale all'incirca a questa età gestazionale.
Oligoidramnios/insufficienza renale neonatale
L'uso di FANS, tra cui NAPROSYN compresse, EC-NAPROSYN 250 mg e ANAPROX DS, a circa 20 settimane di gestazione o più tardi durante la gravidanza può causare disfunzione renale fetale che porta a oligoidramnios e, in alcuni casi, insufficienza renale neonatale. Questi esiti avversi si osservano, in media, dopo giorni o settimane di trattamento, sebbene l'oligoidramnios sia stato raramente segnalato non appena 48 ore dopo l'inizio dei FANS. L'oligoidramnios è spesso, ma non sempre, reversibile con l'interruzione del trattamento. Le complicanze dell'oligoidramnios prolungato possono, ad esempio, includere contratture degli arti e ritardata maturazione polmonare. In alcuni casi post-marketing di compromissione della funzionalità renale neonatale, sono state necessarie procedure invasive come trasfusione di scambio o dialisi.
Se il trattamento con FANS è necessario tra circa 20 settimane e 30 settimane di gestazione, limitare l'uso di NAPROSYN 250 mg compresse, EC-NAPROSYN 250 mg o ANAPROX DS alla dose efficace più bassa e alla durata più breve possibile. Prendere in considerazione il monitoraggio ecografico del liquido amniotico se il trattamento con compresse NAPROSYN, EC-NAPROSYN o ANAPROX DS si estende oltre le 48 ore. Interrompere NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS se si verifica oligoidramnios e seguire la pratica clinica [vedi Utilizzare in popolazioni specifiche ].
Tossicità ematologica
Si è verificata anemia nei pazienti trattati con FANS. Ciò può essere dovuto a perdita di sangue occulta o grossolana, ritenzione di liquidi o un effetto non completamente descritto sull'eritropoiesi. Se un paziente trattato con NAPROSYN compresse, EC-NAPROSYN 500 mg o ANAPROX DS presenta segni o sintomi di anemia, monitorare l'emoglobina o l'ematocrito.
FANS, inclusi NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS, possono aumentare il rischio di eventi emorragici. Condizioni di comorbilità come disturbi della coagulazione o uso concomitante di warfarin e altri anticoagulanti, agenti antipiastrinici (p. es., aspirina), inibitori della ricaptazione della serotonina (SSRI) e inibitori della ricaptazione della serotonina e della noradrenalina (SNRI) possono aumentare questo rischio. Monitorare questi pazienti per segni di sanguinamento [vedi INTERAZIONI DI DROGA ].
Mascheramento di infiammazione e febbre
L'attività farmacologica di NAPROSYN compresse, EC-NAPROSYN 500 mg e ANAPROX DS nel ridurre l'infiammazione e possibilmente la febbre, può diminuire l'utilità dei segni diagnostici nel rilevare le infezioni.
Uso a lungo termine e monitoraggio di laboratorio
Poiché possono verificarsi gravi emorragie gastrointestinali, epatotossicità e danno renale senza sintomi o segni premonitori, prendere in considerazione il monitoraggio periodico dei pazienti in trattamento con FANS a lungo termine con un CBC e un profilo chimico [vedere AVVERTENZE E PRECAUZIONI ].
I pazienti con valori di emoglobina iniziali di 10 g o meno che devono ricevere una terapia a lungo termine devono avere valori di emoglobina determinati periodicamente.
A causa dei riscontri oculari avversi negli studi sugli animali con farmaci di questa classe, si raccomanda di eseguire studi oftalmici se si verificano cambiamenti o disturbi della vista.
Informazioni di consulenza per il paziente
Consigliare al paziente di leggere l'etichettatura del paziente approvata dalla FDA (Guida ai farmaci) che accompagna ogni prescrizione dispensata. Informare i pazienti, le famiglie o i loro caregiver delle seguenti informazioni prima di iniziare la terapia con NAPROSYN compresse, EC-NAPROSYN o ANAPROX DS e periodicamente durante il corso della terapia in corso.
Eventi trombotici cardiovascolari
Consigliare ai pazienti di prestare attenzione ai sintomi di eventi trombotici cardiovascolari, inclusi dolore toracico, mancanza di respiro, debolezza o difficoltà di parola, e di riferire immediatamente uno qualsiasi di questi sintomi al proprio medico curante [vedi AVVERTENZE E PRECAUZIONI ].
Sanguinamento gastrointestinale, ulcera e perforazione
Consigliare ai pazienti di segnalare i sintomi di ulcerazioni ed emorragie, inclusi dolore epigastrico, dispepsia, melena ed ematemesi al proprio medico. Nel contesto dell'uso concomitante di aspirina a basso dosaggio per la profilassi cardiaca, informare i pazienti dell'aumento del rischio e dei segni e sintomi di sanguinamento gastrointestinale [vedi AVVERTENZE E PRECAUZIONI ].
Epatotossicità
Informare i pazienti dei segnali premonitori e dei sintomi di epatotossicità (p. es., nausea, affaticamento, letargia, prurito, diarrea, ittero, dolorabilità del quadrante superiore destro e sintomi "simil-influenzali"). Se ciò si verifica, chiedere ai pazienti di interrompere NAPROSYN 500 mg compresse, EC-NAPROSYN 250 mg o ANAPROX DS e cercare una terapia medica immediata [vedere AVVERTENZE E PRECAUZIONI ].
Insufficienza cardiaca ed edema
Consigliare ai pazienti di prestare attenzione ai sintomi di insufficienza cardiaca congestizia, inclusi mancanza di respiro, aumento di peso inspiegabile o edema e di contattare il proprio medico se si verificano tali sintomi [vedere AVVERTENZE E PRECAUZIONI ].
Reazioni anafilattiche
Informare i pazienti dei segni di una reazione anafilattica (p. es., difficoltà respiratorie, gonfiore del viso o della gola). Istruire i pazienti a cercare un aiuto immediato di emergenza se questi si verificano [vedi CONTROINDICAZIONI e AVVERTENZE E PRECAUZIONI ].
Gravi reazioni cutanee, incluso DRESS
Consigliare ai pazienti di interrompere immediatamente l'assunzione di NAPROSYN 250 mg compresse, EC-NAPROSYN 500 mg o ANAPROX DS se sviluppano qualsiasi tipo di eruzione cutanea o febbre e di contattare il proprio medico il prima possibile [vedere AVVERTENZE E PRECAUZIONI ].
Fertilità femminile
Informare le donne in età fertile che desiderano una gravidanza che i FANS, comprese le compresse di NAPROSYN, ECNAPROSYN 250 mg e ANAPROX DS, possono essere associati a un ritardo reversibile dell'ovulazione (vedi Utilizzare in popolazioni specifiche .]
Tossicità fetale
Informare le donne in gravidanza di evitare l'uso di NAPROSYN 250 mg compresse, EC-NAPROSYN o ANAPROX DS e altri FANS a partire dalla 30 settimana di gestazione a causa del rischio di chiusura prematura del dotto arterioso fetale. Se è necessario il trattamento con NAPROSYN compresse, EC-NAPROSYN 500 mg o ANAPROX DS per una donna incinta tra circa 20 e 30 settimane di gestazione, informarla che potrebbe aver bisogno di essere monitorata per l'oligoidramnios, se il trattamento continua per più di 48 ore [vedere AVVERTENZE E PRECAUZIONI e Utilizzare in popolazioni specifiche ].
Evitare l'uso concomitante di FANS
Informare i pazienti che l'uso concomitante di NAPROSYN compresse, EC-NAPROSYN 500 mg e ANAPROX DS con altri FANS o salicilati (p. es., diflunisal, salsalato) non è raccomandato a causa dell'aumento del rischio di tossicità gastrointestinale e di un aumento minimo o nullo dell'efficacia [vedere AVVERTENZE E PRECAUZIONI e INTERAZIONI DI DROGA ]. Avvisare i pazienti che i FANS possono essere presenti nei farmaci "da banco" per il trattamento di raffreddore, febbre o insonnia.
Uso di FANS e aspirina a basso dosaggio
Informare i pazienti di non usare l'aspirina a basso dosaggio in concomitanza con NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS fino a quando non parlano con il proprio medico [vedere INTERAZIONI DI DROGA ].
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Cancerogenesi
È stato condotto uno studio di 2 anni sui ratti per valutare il potenziale cancerogeno del naprossene a dosi di ratto di 8, 16 e 24 mg/kg/giorno (0,05, 0,1 e 0,16 volte la dose massima giornaliera raccomandata nell'uomo [MRHD] di 1500 mg/giorno sulla base di un confronto della superficie corporea). Non è stata trovata alcuna evidenza di tumorigenicità.
Mutagenesi
Il naprossene è risultato positivo nel test di scambio dei cromatidi fratelli in vivo ma non è risultato mutageno nel test di mutazione inversa batterica in vitro (test di Ames).
Compromissione della fertilità
ratti maschi sono stati trattati con 2, 5, 10 e 20 mg/kg di naprossene per via orale per 60 giorni prima dell'accoppiamento e le femmine di ratto sono state trattate con le stesse dosi per 14 giorni prima dell'accoppiamento e per i primi 7 giorni di gravidanza. Non sono stati osservati effetti avversi sulla fertilità (fino a 0,13 volte l'MRDH in base alla superficie corporea).
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
L'uso di FANS, tra cui NAPROSYN 250 mg compresse, EC-NAPROSYN e ANAPROX DS, può causare la chiusura prematura del dotto arterioso fetale e disfunzione renale fetale che porta a oligoidramnios e, in alcuni casi, insufficienza renale neonatale. A causa di questi rischi, limitare la dose e la durata di NAPROSYN compresse, EC-NAPROSYN 500 mg o ANAPROX DS utilizzare tra circa 20 e 30 settimane di gestazione ed evitare l'uso di NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS a circa 30 settimane di gestazione e successivamente in gravidanza (v Considerazioni cliniche , Dati ).
Chiusura prematura del dotto arterioso fetale
L'uso di FANS, tra cui NAPROSYN compresse, EC-NAPROSYN e ANAPROX DS, a circa 30 settimane di gestazione o più tardi in gravidanza aumenta il rischio di chiusura prematura del dotto arterioso fetale.
Oligoidramnios/insufficienza renale neonatale
L'uso di FANS a circa 20 settimane di gestazione o più tardi in gravidanza è stato associato a casi di disfunzione renale fetale che porta a oligoidramnios e, in alcuni casi, a insufficienza renale neonatale.
I dati provenienti da studi osservazionali riguardanti altri potenziali rischi embriofetali dell'uso di FANS nelle donne nel primo o nel secondo trimestre di gravidanza non sono conclusivi. Negli studi sulla riproduzione animale nel ratto, nel coniglio e nel topo non vi sono evidenze di teratogenicità o danno fetale quando il naprossene è stato somministrato durante il periodo dell'organogenesi a dosi rispettivamente di 0,13, 0,26 e 0,6 volte la dose massima giornaliera raccomandata nell'uomo di 1500 mg/die, rispettivamente. vedere Dati ]. Sulla base di dati sugli animali, è stato dimostrato che le prostaglandine hanno un ruolo importante nella permeabilità vascolare endometriale, nell'impianto di blastocisti e nella decidualizzazione. Negli studi sugli animali, la somministrazione di inibitori della sintesi delle prostaglandine come il naprossene ha comportato un aumento della perdita pre e post impianto. È stato anche dimostrato che le prostaglandine hanno un ruolo importante nello sviluppo del rene fetale. In studi sugli animali pubblicati, è stato riportato che gli inibitori della sintesi delle prostaglandine compromettono lo sviluppo renale se somministrati a dosi clinicamente rilevanti.
Il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo per le popolazioni indicate non è noto. Tutte le gravidanze hanno un rischio di fondo di difetti alla nascita, perdita o altri esiti avversi. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo nelle gravidanze clinicamente riconosciute è rispettivamente del 2% e del 4% e del 15% e del 20%.
Considerazioni cliniche
Reazioni avverse fetali/neonatali
Chiusura prematura del dotto arterioso fetale
Evitare l'uso di FANS nelle donne a circa 30 settimane di gestazione e successivamente in gravidanza, poiché i FANS, tra cui NAPROSYN 500 mg compresse, EC-NAPROSYN 250 mg e ANAPROX DS, possono causare la chiusura prematura del dotto arterioso fetale (vedi Dati ).
Oligoidramnios/insufficienza renale neonatale
Se un FANS è necessario a circa 20 settimane di gestazione o più tardi in gravidanza, limitare l'uso alla dose efficace più bassa e alla durata più breve possibile. Se il trattamento con compresse NAPROSYN, EC-NAPROSYN o ANAPROX DS si estende oltre le 48 ore, prendere in considerazione il monitoraggio con ultrasuoni per l'oligoidramnios. Se si verifica oligoidramnios, interrompere NAPROSYN 250 mg compresse, ECNAPROSYN 250 mg e ANAPROX DS e seguire la pratica clinica (vedere Dati ).
Manodopera o consegna
Non ci sono studi sugli effetti di NAPROSYN compresse, EC-NAPROSYN o ANAPROX DS durante il travaglio o il parto. Negli studi sugli animali, i FANS, incluso il naprossene, inibiscono la sintesi delle prostaglandine, causano un parto ritardato e aumentano l'incidenza di natimortalità.
Dati
Dati umani
Ci sono alcune prove che suggeriscono che quando gli inibitori della sintesi delle prostaglandine vengono utilizzati per ritardare il travaglio pretermine, vi è un aumentato rischio di complicanze neonatali come enterocolite necrotizzante, dotto arterioso pervio ed emorragia intracranica. Il trattamento con naprossene somministrato nella tarda gravidanza per ritardare il parto è stato associato a ipertensione polmonare persistente, disfunzione renale e livelli anormali di prostaglandina E nei neonati pretermine. A causa degli effetti noti dei farmaci antinfiammatori non steroidei sul sistema cardiovascolare fetale (chiusura del dotto arterioso), l'uso durante la gravidanza (in particolare a partire dalla 30 settimana di gestazione o dal terzo trimestre) deve essere evitato.
Chiusura prematura del dotto arterioso fetale
La letteratura pubblicata riporta che l'uso di FANS a circa 30 settimane di gestazione e successivamente in gravidanza può causare la chiusura prematura del dotto arterioso fetale.
Oligoidramnios/insufficienza renale neonatale
Gli studi pubblicati e le relazioni post-marketing descrivono l'uso materno di FANS a circa 20 settimane di gestazione o più tardi in gravidanza associato a disfunzione renale fetale che porta a oligoidramnios e, in alcuni casi, compromissione renale neonatale. Questi esiti avversi si osservano, in media, dopo giorni o settimane di trattamento, sebbene l'oligoidramnios sia stato raramente segnalato non appena 48 ore dopo l'inizio dei FANS. In molti casi, ma non in tutti, la diminuzione del liquido amniotico è stata transitoria e reversibile con la cessazione del farmaco. C'è stato un numero limitato di segnalazioni di casi di uso materno di FANS e disfunzione renale neonatale senza oligoidramnios, alcuni dei quali erano irreversibili. Alcuni casi di disfunzione renale neonatale hanno richiesto un trattamento con procedure invasive, come la trasfusione di sangue o la dialisi.
limiti metodologici di questi studi e relazioni post-marketing includono la mancanza di un gruppo di controllo; informazioni limitate su dose, durata e tempi di esposizione al farmaco; e uso concomitante di altri farmaci. Queste limitazioni precludono di stabilire una stima affidabile del rischio di esiti avversi fetali e neonatali con l'uso materno di FANS. Poiché i dati di sicurezza pubblicati sugli esiti neonatali riguardavano principalmente neonati pretermine, la generalizzabilità di alcuni rischi segnalati per il neonato a termine esposto ai FANS attraverso l'uso materno è incerta.
Dati sugli animali
Sono stati condotti studi sulla riproduzione nei ratti a 20 mg/kg/die (0,13 volte la dose massima giornaliera raccomandata nell'uomo di 1500 mg/die in base al confronto della superficie corporea), conigli a 20 mg/kg/die (0,26 volte la dose massima raccomandata dose giornaliera umana, basata sul confronto della superficie corporea) e topi a 170 mg/kg/giorno (0,6 volte la dose massima giornaliera raccomandata nell'uomo in base al confronto della superficie corporea) senza evidenza di ridotta fertilità o danni al feto dovuti a la droga.
Allattamento
Riepilogo dei rischi
L'anione naprossene è stato trovato nel latte delle donne che allattano ad una concentrazione equivalente a circa l'1% della concentrazione massima di naprossene nel plasma. I benefici per lo sviluppo e la salute dell'allattamento al seno devono essere considerati insieme alla necessità clinica della madre di NAPROSYN compresse, EC-NAPROSYN 500 mg o ANAPROX DS e qualsiasi potenziale effetto avverso sul bambino allattato al seno dalle compresse NAPROSYN, EC-NAPROSYN o ANAPROX DS o dalla condizione materna sottostante.
Femmine E Maschi Di Potenziale Riproduttivo
Infertilità
Femmine
In base al meccanismo d'azione, l'uso di FANS mediati dalle prostaglandine, inclusi NAPROSYN compresse, ECNAPROSYN e ANAPROX DS, può ritardare o prevenire la rottura dei follicoli ovarici, che è stata associata a infertilità reversibile in alcune donne. Studi sugli animali pubblicati hanno dimostrato che la somministrazione di inibitori della sintesi delle prostaglandine ha il potenziale per interrompere la rottura follicolare mediata dalle prostaglandine necessaria per l'ovulazione. Piccoli studi su donne trattate con FANS hanno anche mostrato un ritardo reversibile nell'ovulazione. Prendere in considerazione la sospensione dei FANS, comprese le compresse di NAPROSYN, EC-NAPROSYN e ANAPROX DS, nelle donne che hanno difficoltà a concepire o che sono sottoposte a indagini sull'infertilità.
Uso pediatrico
La sicurezza e l'efficacia nei pazienti pediatrici di età inferiore ai 2 anni non sono state stabilite. Le raccomandazioni sul dosaggio pediatrico per l'artrite idiopatica giovanile poliarticolare si basano su studi ben controllati [vedi DOSAGGIO E SOMMINISTRAZIONE ]. Non ci sono dati adeguati sull'efficacia o sulla dose-risposta per altre condizioni pediatriche, ma l'esperienza nell'artrite idiopatica giovanile poliarticolare e altre esperienze di utilizzo hanno stabilito che dosi singole da 2,5 a 5 mg/kg come sospensione di naprossene, con una dose giornaliera totale non superiore a 15 mg/kg/die, sono ben tollerati nei pazienti pediatrici di età superiore ai 2 anni.
Uso geriatrico
La tollerabilità epatica e renale della somministrazione a lungo termine di naprossene è stata studiata in due studi clinici in doppio cieco che hanno coinvolto 586 pazienti. Dei pazienti studiati, 98 pazienti avevano un'età pari o superiore a 65 anni e 10 dei 98 pazienti avevano un'età pari o superiore a 75 anni. NAPROXEN è stato somministrato a dosi di 375 mg due volte al giorno o 750 mg due volte al giorno per un massimo di 6 mesi. In alcuni pazienti sono state rilevate anomalie transitorie dei test di laboratorio che valutano la funzionalità epatica e renale, sebbene non siano state rilevate differenze nell'insorgenza di valori anormali tra i diversi gruppi di età.
pazienti anziani, rispetto ai pazienti più giovani, sono a maggior rischio di gravi reazioni avverse cardiovascolari, gastrointestinali e/o renali associate ai FANS. Se il beneficio atteso per il paziente anziano supera questi potenziali rischi, iniziare a somministrare il dosaggio al livello più basso dell'intervallo di dosaggio e monitorare i pazienti per gli effetti avversi [vedere AVVERTENZE E PRECAUZIONI ].
Gli studi indicano che sebbene la concentrazione plasmatica totale di naprossene sia invariata, la frazione plasmatica di naprossene non legata è aumentata negli anziani. Il significato clinico di questo risultato non è chiaro, sebbene sia possibile che l'aumento della concentrazione di naprossene libero possa essere associato ad un aumento del tasso di eventi avversi per un dato dosaggio in alcuni pazienti anziani. Si consiglia cautela quando sono necessarie dosi elevate e può essere necessario un aggiustamento del dosaggio nei pazienti anziani. Come con altri farmaci usati negli anziani, è prudente usare la dose efficace più bassa.
L'esperienza indica che i pazienti geriatrici possono essere particolarmente sensibili a determinati effetti avversi dei farmaci antinfiammatori non steroidei. I pazienti anziani o debilitati sembrano tollerare meno bene l'ulcera peptica o il sanguinamento quando si verificano questi eventi. La maggior parte delle segnalazioni spontanee di eventi gastrointestinali fatali sono nella popolazione geriatrica [vedi AVVERTENZE E PRECAUZIONI ].
È noto che il naprossene viene sostanzialmente escreto dai reni e il rischio di reazioni tossiche a questo farmaco può essere maggiore nei pazienti con funzionalità renale compromessa. Poiché i pazienti anziani hanno maggiori probabilità di avere una funzione renale ridotta, occorre prestare attenzione nella selezione della dose e può essere utile monitorare la funzione renale [vedere FARMACOLOGIA CLINICA ]. I pazienti geriatrici possono essere maggiormente a rischio per lo sviluppo di una forma di tossicità renale precipitata da una ridotta formazione di prostaglandine durante la somministrazione di farmaci antinfiammatori non steroidei [vedi AVVERTENZE E PRECAUZIONI ].
Insufficienza epatica
Si consiglia cautela quando sono necessarie dosi elevate e in questi pazienti possono essere necessari alcuni aggiustamenti del dosaggio. È prudente usare la dose efficace più bassa [vedi FARMACOLOGIA CLINICA ].
Insufficienza renale
I prodotti contenenti naprossene non sono raccomandati per l'uso in pazienti con insufficienza renale da moderata a grave e grave (clearance della creatinina AVVERTENZE E PRECAUZIONI , FARMACOLOGIA CLINICA ].
OVERDOSE
I sintomi a seguito di sovradosaggi acuti da FANS sono stati tipicamente limitati a letargia, sonnolenza, nausea, vomito e dolore epigastrico, che sono stati generalmente reversibili con terapia di supporto. Si è verificata un'emorragia gastrointestinale. Si sono verificati ipertensione, insufficienza renale acuta, depressione respiratoria e coma, ma sono stati rari [vedi AVVERTENZE E PRECAUZIONI ].Poiché il naprossene sodico può essere assorbito rapidamente, dovrebbero essere previsti livelli ematici elevati e precoci.
Alcuni pazienti hanno avuto convulsioni, ma non è chiaro se queste fossero o meno correlate al farmaco. Non è noto quale dose del farmaco sarebbe pericolosa per la vita. [vedere AVVERTENZE E PRECAUZIONI ].
Gestire i pazienti con cure sintomatiche e di supporto a seguito di un sovradosaggio di FANS. Non ci sono antidoti specifici.
Considerare vomito e/o carbone attivo (da 60 a 100 grammi negli adulti, da 1 a 2 grammi per kg di peso corporeo nei pazienti pediatrici) e/o catartico osmotico nei pazienti sintomatici osservati entro quattro ore dall'ingestione o in pazienti con un sovradosaggio elevato ( da 5 a 10 volte la dose raccomandata). La diuresi forzata, l'alcalinizzazione delle urine, l'emodialisi o l'emoperfusione possono non essere utili a causa dell'elevato legame proteico.
Per ulteriori informazioni sul trattamento del sovradosaggio contattare un centro antiveleni (1-800-222-1222).
CONTROINDICAZIONI
NAPROSYN 500 mg compresse, EC-NAPROSYN e ANAPROX DS sono controindicati nei seguenti pazienti:
- Ipersensibilità nota (p. es., reazioni anafilattiche e reazioni cutanee gravi) al naprossene o a qualsiasi componente del medicinale [vedi AVVERTENZE E PRECAUZIONI ]
- Storia di asma, orticaria o altre reazioni di tipo allergico dopo l'assunzione di aspirina o altri FANS. In tali pazienti sono state riportate reazioni anafilattiche gravi, talvolta fatali, ai FANS [vedi AVVERTENZE E PRECAUZIONI ]
- Nel contesto della chirurgia del bypass coronarico (CABG) [vedi AVVERTENZE E PRECAUZIONI ]
FARMACOLOGIA CLINICA
Meccanismo di azione
Il naprossene ha proprietà analgesiche, antinfiammatorie e antipiretiche. ANAPROX DS (naprossene sodico) è stato sviluppato come formulazione di naprossene ad assorbimento più rapido da utilizzare come analgesico.
Il meccanismo d'azione del naprossene, come quello di altri FANS, non è completamente compreso ma comporta l'inibizione della ciclossigenasi (COX-1 e COX-2).
Il naprossene è un potente inibitore della sintesi delle prostaglandine in vitro. Le concentrazioni di naprossene raggiunte durante la terapia hanno prodotto effetti in vivo. Le prostaglandine sensibilizzano i nervi afferenti e potenziano l'azione della bradichinina nell'indurre il dolore nei modelli animali. Le prostaglandine sono mediatori dell'infiammazione. Poiché il naprossene è un inibitore della sintesi delle prostaglandine, il suo meccanismo d'azione può essere dovuto a una diminuzione delle prostaglandine nei tessuti periferici.
Farmacodinamica
In uno studio su volontari sani, 10 giorni di somministrazione concomitante di naprossene 220 mg una volta al giorno con aspirina a rilascio immediato a basso dosaggio (81 mg) hanno mostrato un'interazione con l'attività antipiastrinica dell'aspirina misurata dalla % di inibizione del trombossano B2 sierico a 24 ore dopo la dose del giorno 10 [98,7% (aspirina da sola) vs 93,1% (naprossene e aspirina)]. L'interazione è stata osservata anche dopo l'interruzione del naprossene il giorno 11 (mentre la dose di aspirina è stata continuata) ma si è normalizzata entro il giorno 13. Nello stesso studio, l'interazione è stata maggiore quando il naprossene è stato somministrato 30 minuti prima dell'aspirina [98,7% vs 87,7%] e minimo quando l'aspirina è stata somministrata 30 minuti prima del naprossene [98,7% vs 95,4%].
Dopo la somministrazione di naprossene 220 mg due volte al giorno con aspirina a rilascio immediato a basso dosaggio (prima dose di naprossene somministrata 30 minuti prima dell'aspirina), l'interazione è stata minima a 24 ore dopo la dose del giorno 10 [98,7% vs 95,7%]. Tuttavia, l'interazione era più evidente dopo l'interruzione del naprossene (washout) il giorno 11 [98,7% vs 84,3%] e non si normalizzava completamente entro il giorno 13 [98,5% vs 90,7%]. [vedere INTERAZIONI DI DROGA ].
Farmacocinetica
Il naprossene e il naprossene sodico vengono rapidamente e completamente assorbiti dal tratto gastrointestinale con una biodisponibilità in vivo del 95%. Le diverse forme di dosaggio di NAPROSYN 250 mg sono bioequivalenti in termini di grado di assorbimento (AUC) e concentrazione di picco (Cmax); tuttavia, i prodotti differiscono nel loro schema di assorbimento. Queste differenze tra i prodotti a base di naprossene sono legate sia alla forma chimica del naprossene utilizzata che alla sua formulazione. Anche con le differenze osservate nel modello di assorbimento, l'emivita di eliminazione del naprossene è invariata tra i prodotti che vanno da 12 a 17 ore. I livelli di naprossene allo stato stazionario vengono raggiunti in 4-5 giorni e il grado di accumulo di naprossene è coerente con questa emivita. Ciò suggerisce che le differenze nella modalità di rilascio giocano solo un ruolo trascurabile nel raggiungimento dei livelli plasmatici allo stato stazionario.
Assorbimento
NAPROSYN compresse/ANAPROX DS
Dopo la somministrazione di NAPROSYN 500 mg compresse, i livelli plasmatici di picco vengono raggiunti in 2-4 ore. Dopo la somministrazione orale di ANAPROX DS, i livelli plasmatici di picco vengono raggiunti in 1-2 ore. La differenza di velocità tra i due prodotti è dovuta alla maggiore solubilità in acqua del sale sodico del naprossene utilizzato in ANAPROX DS.
CE-NAPROSYN
EC-NAPROSYN è progettato con un rivestimento sensibile al pH per fornire una barriera alla disintegrazione nell'ambiente acido dello stomaco e per perdere l'integrità nell'ambiente più neutro dell'intestino tenue. Il rivestimento polimerico enterico selezionato per EC-NAPROSYN 250 mg si dissolve al di sopra del pH 6. Quando EC-NAPROSYN è stato somministrato a soggetti a digiuno, i livelli plasmatici di picco sono stati raggiunti da circa 4 a 6 ore dopo la prima dose (intervallo: da 2 a 12 ore). Uno studio in vivo nell'uomo che utilizzava compresse radiomarcate di EC-NAPROSYN da 250 mg ha dimostrato che EC-NAPROSYN si dissolve principalmente nell'intestino tenue piuttosto che nello stomaco, quindi l'assorbimento del farmaco viene ritardato fino allo svuotamento dello stomaco.
Quando EC-NAPROSYN e NAPROSYN 500 mg compresse sono stati somministrati a soggetti a digiuno (n=24) in uno studio crossover dopo 1 settimana di somministrazione, sono state osservate differenze nel tempo per raggiungere i livelli plasmatici di picco (Tmax), ma non ci sono state differenze nell'assorbimento totale poiché misurato da Cmax e AUC:
Effetti antiacidi
Quando EC-NAPROSYN 250 mg è stato somministrato in dose singola con antiacido (capacità tampone 54 mEq), i livelli plasmatici di picco di naprossene sono rimasti invariati, ma il tempo al picco è stato ridotto (Tmax medio a digiuno 5,6 ore, Tmax medio con antiacido 5 ore) , anche se non in modo significativo [vedi INTERAZIONI DI DROGA ].
Effetti alimentari
Quando EC-NAPROSYN 500 mg è stato somministrato in dose singola con il cibo, i livelli plasmatici di picco nella maggior parte dei soggetti sono stati raggiunti in circa 12 ore (intervallo: da 4 a 24 ore). Il tempo di permanenza nell'intestino tenue fino alla disintegrazione era indipendente dall'assunzione di cibo. La presenza di cibo ha prolungato il tempo di permanenza delle compresse nello stomaco, il tempo ai primi livelli sierici rilevabili di naprossene e il tempo ai livelli massimi di naprossene (Tmax), ma non ha influenzato i livelli di picco di naprossene (Cmax).
Distribuzione
Il naprossene ha un volume di distribuzione di 0,16 L/kg. A livelli terapeutici il naprossene è maggiore del 99% legato all'albumina. A dosi di naprossene superiori a 500 mg/die si ha un aumento meno che proporzionale dei livelli plasmatici a causa di un aumento della clearance causato dalla saturazione del legame con le proteine plasmatiche a dosi più elevate (minimo medio di Css 36,5, 49,2 e 56,4 mg/L con 500, rispettivamente di 1000 e 1500 mg al giorno di naprossene). L'anione naprossene è stato trovato nel latte delle donne che allattano ad una concentrazione equivalente a circa l'1% della concentrazione massima di naprossene nel plasma [vedi Utilizzare in popolazioni specifiche ].
Eliminazione
Metabolismo
Il naprossene è ampiamente metabolizzato nel fegato in 6-0-desmetil naprossene e sia il genitore che i metaboliti non inducono enzimi metabolizzanti. Sia il naprossene che il 6-0-desmetil naprossene vengono ulteriormente metabolizzati nei rispettivi metaboliti coniugati con acilglucuronide.
Escrezione
La clearance del naprossene è 0,13 ml/min/kg. Circa il 95% del naprossene di qualsiasi dose viene escreto nelle urine, principalmente come naprossene ( AVVERTENZE E PRECAUZIONI ].
Popolazioni specifiche
pediatrico
Nei pazienti pediatrici di età compresa tra 5 e 16 anni con artrite, livelli plasmatici di naprossene dopo una singola dose di 5 mg/kg di naprossene sospensione [vedere DOSAGGIO E SOMMINISTRAZIONE sono risultati simili a quelli riscontrati negli adulti normali dopo una dose di 500 mg. L'emivita terminale sembra essere simile nei pazienti pediatrici e adulti. Non sono stati condotti studi di farmacocinetica sul naprossene in pazienti pediatrici di età inferiore ai 5 anni. I parametri farmacocinetici sembrano essere simili dopo la somministrazione di sospensione o compresse di naprossene in pazienti pediatrici.
geriatrico
Gli studi indicano che sebbene la concentrazione plasmatica totale di naprossene sia invariata, la frazione plasmatica libera di naprossene è aumentata negli anziani, sebbene la frazione libera sia
Insufficienza epatica
La farmacocinetica del naprossene non è stata determinata in soggetti con insufficienza epatica.
L'epatopatia alcolica cronica e probabilmente altre malattie con proteine plasmatiche ridotte o anormali (albumina) riducono la concentrazione plasmatica totale di naprossene, ma la concentrazione plasmatica di naprossene non legato è aumentata.
Insufficienza renale
La farmacocinetica del naprossene non è stata determinata nei soggetti con insufficienza renale. Dato che il naprossene, i suoi metaboliti e coniugati sono escreti principalmente dal rene, esiste la possibilità che i metaboliti del naprossene si accumulino in presenza di insufficienza renale. L'eliminazione del naprossene è ridotta nei pazienti con insufficienza renale grave.
Studi sull'interazione tra farmaci
Aspirina
Quando i FANS sono stati somministrati con l'aspirina, il legame proteico dei FANS è stato ridotto, sebbene la clearance dei FANS liberi non fosse alterata. Il significato clinico di questa interazione non è noto. Vedere la Tabella 1 per le interazioni farmacologiche clinicamente significative dei FANS con l'aspirina [vedi INTERAZIONI DI DROGA ].
Studi clinici
Il naprossene è stato studiato in pazienti con artrite reumatoide, osteoartrite, artrite idiopatica giovanile poliarticolare, spondilite anchilosante, tendinite e borsite e gotta acuta. Il miglioramento nei pazienti trattati per l'artrite reumatoide è stato dimostrato da una riduzione del gonfiore articolare, una riduzione della durata della rigidità mattutina, una riduzione dell'attività della malattia valutata sia dallo sperimentatore che dal paziente e da una maggiore mobilità come dimostrato da una riduzione del tempo di deambulazione . In generale, non è stato riscontrato che la risposta al naprossene dipenda dall'età, dal sesso, dalla gravità o dalla durata dell'artrite reumatoide.
Nei pazienti con osteoartrite, l'azione terapeutica del naprossene è stata dimostrata da una riduzione del dolore o della dolorabilità articolare, un aumento del range di movimento delle articolazioni del ginocchio, una maggiore mobilità come dimostrato da una riduzione del tempo di deambulazione e un miglioramento della capacità di svolgere attività della vita quotidiana alterata dalla malattia.
In uno studio clinico che ha confrontato le formulazioni standard di naprossene 375 mg due volte al giorno (750 mg al giorno) rispetto a 750 mg due volte al giorno (1500 mg/giorno), 9 pazienti nel gruppo 750 mg hanno interrotto prematuramente a causa di eventi avversi. Diciannove pazienti nel gruppo 1500 mg hanno interrotto prematuramente a causa di eventi avversi. La maggior parte di questi eventi avversi erano eventi gastrointestinali.
Negli studi clinici su pazienti con artrite reumatoide, osteoartrite e artrite idiopatica giovanile poliarticolare, è stato dimostrato che il naprossene è paragonabile all'aspirina e all'indometacina nel controllo delle suddette misure dell'attività della malattia, ma la frequenza e la gravità degli effetti avversi gastrointestinali più lievi (nausea , dispepsia, bruciore di stomaco) e gli effetti avversi sul sistema nervoso (acufene, vertigini, stordimento) sono stati minori nei pazienti trattati con naprossene rispetto a quelli trattati con aspirina o indometacina.
Nei pazienti con spondilite anchilosante, è stato dimostrato che il naprossene riduce il dolore notturno, la rigidità mattutina e il dolore a riposo. In studi in doppio cieco il farmaco ha dimostrato di essere efficace quanto l'aspirina, ma con meno effetti collaterali.
Nei pazienti con gotta acuta, una risposta favorevole al naprossene è stata dimostrata da una significativa riduzione delle alterazioni infiammatorie (p. es., diminuzione del gonfiore, calore) entro 24-48 ore, nonché dal sollievo del dolore e della dolorabilità.
Il naprossene è stato studiato in pazienti con dolore da lieve a moderato secondario a episiotomia postoperatoria, ortopedica, postpartum e dolore da contrazione uterina e dismenorrea. L'inizio del sollievo dal dolore può iniziare entro 1 ora nei pazienti che assumono naprossene ed entro 30 minuti nei pazienti che assumono naprossene sodico. L'effetto analgesico è stato dimostrato da misure come la riduzione dei punteggi dell'intensità del dolore, l'aumento dei punteggi del sollievo dal dolore, la diminuzione del numero di pazienti che richiedono ulteriori farmaci analgesici e il ritardo nel tempo per la cura. È stato riscontrato che l'effetto analgesico dura fino a 12 ore.
Il naprossene può essere usato con sicurezza in combinazione con sali d'oro e/o corticosteroidi; tuttavia, negli studi clinici controllati, quando aggiunto al regime dei pazienti che ricevevano corticosteroidi, non sembrava causare un miglioramento maggiore rispetto a quello osservato con i soli corticosteroidi. Non è stato adeguatamente studiato se il naprossene abbia un effetto "risparmio di steroidi". Quando aggiunto al regime dei pazienti che ricevevano sali d'oro, il naprossene ha comportato un miglioramento maggiore. Il suo uso in combinazione con salicilati non è raccomandato perché ci sono prove che l'aspirina aumenti il tasso di escrezione del naprossene e i dati sono inadeguati per dimostrare che il naprossene e l'aspirina producono un miglioramento maggiore rispetto a quello ottenuto con l'aspirina da sola. Inoltre, come con altri FANS, la combinazione può determinare una frequenza di eventi avversi maggiore rispetto a quella dimostrata per entrambi i prodotti da soli.
In studi di gastroscopia e perdita di sangue del 51Cr con volontari normali, è stato dimostrato che la somministrazione giornaliera di 1000 mg di naprossene come 1000 mg di NAPROSYN (naprossene) o 1100 mg di ANAPROX DS (naprossene sodico) provoca sanguinamento ed erosione gastrica significativamente inferiori rispetto a 3250 mg di aspirina.
Sono stati condotti tre studi multicentrici, in doppio cieco, della durata di 6 settimane con EC-NAPROSYN (naprossene) (375 o 500 mg due volte al giorno, n=385) e NAPROSYN (375 o 500 mg due volte al giorno, n=279) confrontando EC -NAPROSYN con NAPROSYN, inclusi 355 pazienti con artrite reumatoide e osteoartrite che avevano una storia recente di sintomi gastrointestinali correlati ai FANS. Questi studi hanno indicato che EC-NAPROSYN e NAPROSYN 500 mg non hanno mostrato differenze significative in termini di efficacia o sicurezza e avevano una prevalenza simile di disturbi gastrointestinali minori. I singoli pazienti, tuttavia, possono trovare una formulazione preferibile all'altra.
Cinquecentocinquantatre pazienti hanno ricevuto EC-NAPROSYN durante studi a lungo termine in aperto (la durata media del trattamento era di 159 giorni). I tassi di ulcere peptiche e sanguinamenti gastrointestinali diagnosticati clinicamente erano simili a quanto storicamente riportato per l'uso a lungo termine di FANS.
INFORMAZIONI PER IL PAZIENTE
Guida ai farmaci per i farmaci antinfiammatori non steroidei (FANS)
Qual è l'informazione più importante che dovrei sapere sui medicinali chiamati Farmaci Antinfiammatori Non Steroidei (FANS)?
I FANS possono causare gravi effetti collaterali, tra cui:
- Aumento del rischio di infarto o ictus che può portare alla morte. Questo rischio può verificarsi all'inizio del trattamento e può aumentare:
- con dosi crescenti di FANS
- con un uso più lungo dei FANS
Non assumere i FANS subito prima o dopo un intervento chirurgico al cuore chiamato "innesto di bypass coronarico (CABG)."
Evita di assumere FANS dopo un recente infarto, a meno che non te lo dica il tuo medico. Potresti avere un rischio maggiore di un altro infarto se prendi FANS dopo un recente infarto.
- Aumento del rischio di sanguinamento, ulcere e lacrime (perforazione) dell'esofago (tubo che va dalla bocca allo stomaco), dello stomaco e dell'intestino:
- in qualsiasi momento durante l'uso
- senza sintomi premonitori
- che può causare la morte
Il rischio di contrarre un'ulcera o un'emorragia aumenta con:
- storia passata di ulcere allo stomaco o emorragie gastriche o intestinali con l'uso di FANS
- prendendo medicinali chiamati “corticosteroidi”, “anticoagulanti”, “SSRI” o “SNRI”
- dosi crescenti di FANS
- uso più lungo dei FANS
- fumare
- bevendo alcool
- età avanzata
- cattive condizioni di salute
- malattia epatica avanzata
- problemi di sanguinamento
I FANS dovrebbero essere usati solo:
- esattamente come prescritto
- alla dose più bassa possibile per il trattamento
- per il minor tempo necessario
Cosa sono i FANS?
I FANS sono usati per trattare dolore e arrossamento, gonfiore e calore (infiammazione) causati da condizioni mediche come diversi tipi di artrite, crampi mestruali e altri tipi di dolore a breve termine.
Chi non dovrebbe assumere i FANS?
Non assumere FANS:
- se ha avuto un attacco d'asma, orticaria o altre reazioni allergiche con l'aspirina o altri FANS.
- subito prima o dopo l'intervento chirurgico di bypass cardiaco.
Prima di assumere FANS, informa il tuo medico di tutte le tue condizioni mediche, incluso se:
- ha problemi al fegato o ai reni
- ha la pressione alta
- avere l'asma
- sono incinta o stanno pianificando una gravidanza. L'assunzione di FANS a circa 20 settimane di gravidanza o più tardi può danneggiare il feto. Se hai bisogno di assumere FANS per più di 2 giorni quando hai tra le 20 e le 30 settimane di gravidanza, il tuo medico potrebbe dover monitorare la quantità di liquidi nel tuo grembo intorno al tuo bambino. Non dovresti assumere FANS dopo circa 30 settimane di gravidanza.
- stanno allattando o pianificano di allattare.
Informa il tuo medico di tutti i medicinali che assumi, compresi i medicinali soggetti a prescrizione o da banco, le vitamine o gli integratori a base di erbe. I FANS e alcuni altri medicinali possono interagire tra loro e causare gravi effetti collaterali. Non iniziare a prendere nessun nuovo medicinale senza prima parlarne con il tuo medico.
Quali sono i possibili effetti collaterali dei FANS?
I FANS possono causare gravi effetti collaterali, tra cui:
Vedere "Qual è l'informazione più importante che dovrei sapere sui medicinali chiamati farmaci antinfiammatori non steroidei (FANS)?"
- pressione alta nuova o peggiore
- arresto cardiaco
- problemi al fegato inclusa insufficienza epatica
- problemi renali inclusa insufficienza renale
- globuli rossi bassi (anemia)
- reazioni cutanee pericolose per la vita
- reazioni allergiche pericolose per la vita
Altri effetti collaterali dei FANS includono: mal di stomaco, costipazione, diarrea, gas, bruciore di stomaco, nausea, vomito e vertigini. Ricevi immediatamente un aiuto di emergenza se manifesti uno dei seguenti sintomi:
- mancanza di respiro o difficoltà a respirare
- dolore al petto
- debolezza in una parte o un lato del tuo corpo
- biascicamento
- gonfiore del viso o della gola
Smetti di prendere il tuo FANS e chiama subito il tuo medico se manifesti uno dei seguenti sintomi:
- nausea
- più stanco o più debole del solito
- diarrea
- prurito
- la tua pelle o gli occhi sembrano gialli
- indigestione o mal di stomaco
- sintomi influenzali
- vomitare sangue
- c'è sangue nel tuo movimento intestinale o è nero e appiccicoso come catrame
- aumento di peso insolito
- eruzioni cutanee o vesciche con febbre
- gonfiore di braccia, gambe, mani e piedi
Se assumi una quantità eccessiva di FANS, chiama il tuo medico o chiedi immediatamente assistenza medica.
Questi non sono tutti i possibili effetti collaterali dei FANS. Per ulteriori informazioni, chiedi al tuo medico o al farmacista i FANS.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
Altre informazioni sui FANS
- L'aspirina è un FANS ma non aumenta la possibilità di infarto. L'aspirina può causare sanguinamento nel cervello, nello stomaco e nell'intestino. L'aspirina può anche causare ulcere allo stomaco e all'intestino.
- Alcuni FANS sono venduti in dosi inferiori senza prescrizione medica (da banco). Parla con il tuo medico prima di usare i FANS da banco per più di 10 giorni.
Informazioni generali sull'uso sicuro ed efficace dei FANS
Talvolta i medicinali vengono prescritti per scopi diversi da quelli elencati in una Guida ai farmaci. Non utilizzare i FANS per una condizione per la quale non è stato prescritto. Non somministrare FANS ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Se desideri maggiori informazioni sui FANS, parla con il tuo medico. Puoi chiedere al tuo farmacista o operatore sanitario informazioni sui FANS scritte per gli operatori sanitari.
Questa guida ai farmaci è stata approvata dalla Food and Drug Administration statunitense.
