Proair Inhaler 100mcg Salbutamol Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è ProAir e come viene utilizzato?
ProAir è un medicinale prescritto per il trattamento dei sintomi dell'asma acuto, grave o indotto dall'esercizio (broncospasmo). ProAir può essere utilizzato da solo o con altri farmaci.
ProAir appartiene a una classe di farmaci chiamati PAH, inibitori della PDE-5, inibitori dell'enzima fosfodiesterasi-5.
Non è noto se ProAir sia sicuro ed efficace nei bambini di età inferiore ai 4 anni.
Quali sono i possibili effetti collaterali di ProAir?
ProAir può causare gravi effetti collaterali tra cui:
- ansimando,
- soffocamento,
- altri problemi respiratori,
- dolore al petto,
- battito cardiaco accelerato,
- battiti cardiaci martellanti o svolazzanti nel tuo petto,
- forte mal di testa,
- martellando nel collo o nelle orecchie,
- dolore o bruciore durante la minzione,
- aumento della sete,
- aumento della minzione,
- bocca asciutta,
- odore di alito fruttato,
- crampi alle gambe,
- stipsi,
- battiti cardiaci irregolari,
- aumento della sete o della minzione,
- intorpidimento o formicolio, e
- debolezza muscolare o sensazione di torpore
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di ProAir includono:
- dolore al petto,
- battiti cardiaci veloci o martellanti,
- vertigini,
- sentirsi tremante o nervoso,
- male alla testa,
- mal di schiena,
- dolori muscolari,
- mal di stomaco,
- mal di gola,
- dolore al seno e
- naso che cola o chiuso
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di ProAir. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
Il principio attivo dell'aerosol per inalazione ProAir HFA (albuterol solfato) è l'albuterol solfato, un sale racemico, dell'albuterol. L'albuterolo solfato ha il nome chimico α -[(terz-butilammino) metil]-4-idrossi-m-xilene-α,α'-diol solfato (2:1) (sale) e ha la seguente struttura chimica:
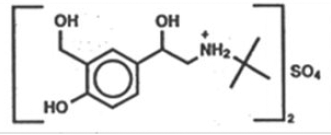
Il peso molecolare dell'albuterol solfato è 576,7 e la formula empirica è (C13H21NO3)2 •H2SO4. Il solfato di salbuta è una polvere cristallina da bianca a biancastra. È solubile in acqua e leggermente solubile in etanolo. L'albuterolo solfato è il nome generico ufficiale negli Stati Uniti e il salbutamolo solfato è il nome generico raccomandato dall'Organizzazione mondiale della sanità. ProAir HFA Inhalation Aerosol è un'unità aerosol pressurizzata a dose misurata con un contatore della dose. ProAir HFA è solo per inalazione orale. Contiene una sospensione microcristallina di albuterol solfato nel propellente HFA-134a (1, 1, 1, 2-tetrafluoroetano) ed etanolo.
Adescare l'inalatore prima del primo utilizzo e nei casi in cui l'inalatore non è stato utilizzato per più di 2 settimane rilasciando tre spruzzi nell'aria, lontano dal viso. Dopo l'adescamento, ogni azionamento eroga 108 mcg di albuterolo solfato, dal boccaglio dell'attuatore (equivalenti a 90 mcg di albuterolo base). Ogni bomboletta fornisce 200 erogazioni (inalazione).
Questo prodotto non contiene clorofluorocarburi (CFC) come propellente.
INDICAZIONI
Broncospasmo
L'aerosol per inalazione PROAIR HFA è indicato per il trattamento o la prevenzione del broncospasmo in pazienti di età pari o superiore a 4 anni con malattia ostruttiva delle vie aeree reversibile.
Broncospasmo indotto dall'esercizio
L'aerosol per inalazione PROAIR HFA è indicato per la prevenzione del broncospasmo indotto dall'esercizio in pazienti di età pari o superiore a 4 anni.
DOSAGGIO E SOMMINISTRAZIONE
Broncospasmo
Per il trattamento degli episodi acuti di broncospasmo o per la prevenzione dei sintomi associati al broncospasmo, il dosaggio abituale per adulti e bambini di età pari o superiore a 4 anni è di due inalazioni ripetute ogni 4-6 ore. Si sconsiglia una somministrazione più frequente o un numero maggiore di inalazioni. In alcuni pazienti può essere sufficiente un'inalazione ogni 4 ore.
Broncospasmo indotto dall'esercizio
La dose abituale per adulti e bambini di età pari o superiore a 4 anni è di due inalazioni da 15 a 30 minuti prima dell'esercizio.
Informazioni sull'amministrazione
Somministrare PROAIR HFA solo per inalazione orale. Agitare bene prima di ogni spruzzo. Per mantenere un uso corretto di questo prodotto e prevenire l'accumulo e il blocco dei farmaci, è importante seguire attentamente le istruzioni per la pulizia.
Adescamento
Adescare l'inalatore prima del primo utilizzo e nei casi in cui l'inalatore non è stato utilizzato per più di 2 settimane rilasciando tre spruzzi nell'aria, lontano dal viso.
Pulizia
Come con tutti gli inalatori di salbutamolo contenenti HFA, per mantenere un uso corretto di questo prodotto e prevenire l'accumulo e il blocco dei farmaci, è importante pulire regolarmente il boccaglio di plastica. L'inalatore può cessare di erogare il farmaco se il boccaglio dell'attuatore in plastica non viene pulito e asciugato adeguatamente. Per pulire: lavare il boccaglio di plastica con acqua corrente tiepida per 30 secondi, scrollarsi di dosso l'acqua in eccesso e asciugare accuratamente all'aria almeno una volta alla settimana. Se il paziente ha più di un inalatore PROAIR HFA, il paziente deve lavarli separatamente per evitare di collegare la bomboletta sbagliata all'attuatore di plastica sbagliato. In questo modo, il paziente può essere certo di conoscere sempre il numero corretto di dosi rimanenti. Non collegare mai una bomboletta di farmaco di un altro inalatore all'attuatore PROAIR HFA e non collegare mai la bomboletta di PROAIR HFA a un attuatore di qualsiasi altro inalatore. Se il boccaglio si blocca, lavare il boccaglio rimuoverà il blocco. Se è necessario utilizzare l'inalatore prima che sia completamente asciutto, scrollarsi di dosso l'acqua in eccesso, sostituire la bomboletta, spruzzare due volte nell'aria lontano dal viso e assumere la dose prescritta. Dopo tale uso, il boccaglio deve essere risciacquato e lasciato asciugare completamente all'aria. [vedere Etichettatura del paziente approvata dalla FDA ].
Contadosi
PROAIR HFA ha un contadosi collegato all'attuatore. Quando il paziente riceve l'inalatore, un punto nero apparirà nella finestra di visualizzazione fino a quando non sarà stato adescato 3 volte, a quel punto verrà visualizzato il numero 200. Il contatore della dose eseguirà il conto alla rovescia ogni volta che viene rilasciato uno spray. Quando il contatore della dose raggiunge 20, il colore dei numeri cambierà in rosso per ricordare al paziente di contattare il farmacista per una ricarica di farmaco o di consultare il proprio medico per una ricarica di prescrizione.
Quando il contatore della dose raggiunge lo 0, lo sfondo diventa rosso fisso. L'inalatore PROAIR HFA deve essere eliminato quando il contatore della dose indica 0 o dopo la data di scadenza sul prodotto, a seconda di quale evento si verifica per primo.
COME FORNITO
Forme di dosaggio e punti di forza
PROAIR HFA è un aerosol per inalazione. PROAIR HFA viene fornito come un contenitore in alluminio pressurizzato da 8,5 g/200 erogazioni con un attuatore in plastica rossa con un contadosi e un cappuccio antipolvere bianco, ciascuno in scatole da uno. Ogni azionamento eroga 120 mcg di albuterol solfato dalla valvola del contenitore e 108 mcg di albuterol solfato dal boccaglio dell'attuatore (equivalenti a 90 mcg di albuterol base).
Stoccaggio e manipolazione
PROAIR HFA (albuterol solfato) Inalazione Aerosol viene fornito come un contenitore pressurizzato in alluminio con un attuatore in plastica rossa con un contadosi e un cappuccio antipolvere bianco ciascuno in scatole da uno. Ogni bomboletta contiene 8,5 g della formulazione e prevede 200 erogazioni ( NDC 59310-579-22). Ogni azionamento eroga 120 mcg di albuterol solfato dalla valvola del contenitore e 108 mcg di albuterol solfato dal boccaglio dell'attuatore (equivalenti a 90 mcg di albuterol base).
AGITARE BENE PRIMA DELL'USO. Conservare tra 15° e 25°C (59° e 77°F). Contenuti sotto pressione. Non forare o incenerire. Proteggere dal gelo e dall'esposizione prolungata alla luce solare diretta. L'esposizione a temperature superiori a 120°F può causare lo scoppio. Per ottenere i migliori risultati, il contenitore deve essere a temperatura ambiente prima dell'uso. Evitare di spruzzare negli occhi. Tenere fuori dalla portata dei bambini.
Vedere Etichettatura del paziente approvata dalla FDA per istruzioni di adescamento e pulizia.
L'attuatore rosso fornito con l'aerosol per inalazione PROAIR HFA non deve essere utilizzato con il contenitore di altri prodotti aerosol per inalazione. La bomboletta spray per inalazione PROAIR HFA non deve essere utilizzata con l'attuatore di altri prodotti aerosol per inalazione.
L'inalatore PROAIR HFA ha un contatore della dose collegato all'attuatore. I pazienti non devono mai tentare di modificare i numeri del contatore della dose o di manomettere il meccanismo a perno all'interno dell'attuatore. Eliminare l'inalatore PROAIR HFA quando il contatore visualizza 0 o dopo la data di scadenza sul prodotto, a seconda di quale evento si verifica per primo. La quantità di farmaco indicata in ciascuna attivazione non può essere garantita dopo che il contatore mostra 0, anche se il contenitore non è completamente vuoto e continuerà a funzionare. Non immergere mai il contenitore nell'acqua per determinare quanto sia pieno il contenitore ("prova di galleggiamento").
L'aerosol per inalazione PROAIR HFA non contiene clorofluorocarburi (CFC) come propellente.
Mktd di: Teva Respiratory, LLC, Frazer, PA 19355. Mfd di: IVAX Pharmaceuticals Ireland Waterford, Irlanda. Revisionato: febbraio 2019
EFFETTI COLLATERALI
L'uso di PROAIR HFA può essere associato a quanto segue:
- Broncospasmo paradosso [vedi AVVERTENZE E PRECAUZIONI ]
- Effetti cardiovascolari [vedi AVVERTENZE E PRECAUZIONI ]
- Reazioni di ipersensibilità immediata [vedi AVVERTENZE E PRECAUZIONI ]
- Ipokaliemia [vedi AVVERTENZE E PRECAUZIONI ]
Esperienza di studi clinici
Un totale di 1090 soggetti sono stati trattati con PROAIR HFA Inhalation Aerosol, o con la stessa formulazione di salbutamolo come in PROAIR HFA Inhalation Aerosol, durante il programma di sviluppo clinico mondiale.
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
Adulti e adolescenti dai 12 anni in su
Le informazioni sulle reazioni avverse presentate nella tabella seguente concernenti l'aerosol per inalazione PROAIR HFA derivano da uno studio in cieco di 6 settimane che ha confrontato l'aerosol per inalazione PROAIR HFA (180 mcg quattro volte al giorno) con un aerosol per inalazione HFA placebo in doppio cieco abbinato e un comparatore attivo commercializzato in cieco per il valutatore HFA-134a albuterolo inalatore in 172 pazienti asmatici di età compresa tra 12 e 76 anni. La tabella elenca l'incidenza di tutti gli eventi avversi (considerati dallo sperimentatore correlati al farmaco o non correlati al farmaco) di questo studio che si sono verificati a un tasso del 3% o superiore nel gruppo di trattamento con aerosol per inalazione PROAIR HFA e più frequentemente nel gruppo PROAIR HFA Gruppo di trattamento con aerosol per inalazione rispetto al gruppo placebo abbinato. Nel complesso, l'incidenza e la natura degli eventi avversi segnalati per PROAIR HFA Inhalation Aerosol e per l'inalatore di salbutamolo HFA-134a, il comparatore attivo commercializzato, erano comparabili.
Incidenza di esperienze avverse (% di pazienti) in uno studio clinico di sei settimane*
Eventi avversi segnalati da meno del 3% dei pazienti che hanno ricevuto PROAIR HFA aerosol per inalazione ma da una percentuale maggiore di pazienti PROAIR HFA aerosol per inalazione rispetto ai pazienti corrispondenti con placebo, che possono essere correlati a PROAIR HFA aerosol per inalazione, inclusi dolore toracico, infezione, diarrea, glossite, lesioni accidentali (sistema nervoso), ansia, dispnea, disturbi dell'orecchio, dolore all'orecchio e infezioni del tratto urinario.
In studi a piccole dosi cumulative, tremore, nervosismo e mal di testa sono stati gli eventi avversi che si sono verificati più frequentemente.
Pazienti pediatrici dai 4 agli 11 anni di età
Gli eventi avversi riportati in uno studio clinico pediatrico di 3 settimane che hanno confrontato la stessa formulazione di albuterolo come in PROAIR HFA Inhalation Aerosol (180 mcg di albuterolo quattro volte al giorno) con un corrispondente placebo HFA aerosol per inalazione si sono verificati con un basso tasso di incidenza (non superiore al 2% nel gruppo di trattamento attivo) ed erano simili a quelli osservati negli studi sugli adulti e sugli adolescenti.
Esperienza di post marketing
Le seguenti reazioni avverse sono state identificate durante l'uso successivo all'approvazione di PROAIR HFA. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco. I rapporti hanno incluso rari casi di broncospasmo aggravato, mancanza di efficacia, esacerbazione dell'asma (riferito fatale in un caso), crampi muscolari e vari effetti collaterali orofaringei come irritazione della gola, gusto alterato, glossite, ulcerazione della lingua e conati di vomito.
seguenti eventi avversi sono stati osservati nell'uso post-approvazione dell'albuterolo per via inalatoria: orticaria, angioedema, eruzione cutanea, broncospasmo, raucedine, edema orofaringeo e aritmie (incluse fibrillazione atriale, tachicardia sopraventricolare, extrasistoli). Inoltre, l'albuterolo, come altri agenti simpaticomimetici, può causare reazioni avverse quali: angina, ipertensione o ipotensione, palpitazioni, stimolazione del sistema nervoso centrale, insonnia, mal di testa, nervosismo, tremore, crampi muscolari, secchezza o irritazione dell'orofaringe, ipokaliemia, iperglicemia e acidosi metabolica.
INTERAZIONI DI DROGA
Altri broncodilatatori aerosol simpaticomimetici a breve durata d'azione non devono essere usati in concomitanza con PROAIR HFA aerosol per inalazione. Se devono essere somministrati ulteriori farmaci adrenergici per qualsiasi via, questi devono essere usati con cautela per evitare effetti cardiovascolari dannosi.
Beta-bloccanti
Gli agenti bloccanti dei recettori beta-adrenergici non solo bloccano l'effetto polmonare dei beta-agonisti, come l'aerosol per inalazione PROAIR HFA, ma possono produrre broncospasmo grave nei pazienti asmatici. Pertanto, i pazienti con asma non devono normalmente essere trattati con beta-bloccanti. Tuttavia, in determinate circostanze, ad esempio come profilassi dopo un infarto del miocardio, potrebbero non esserci alternative accettabili all'uso di agenti beta-bloccanti adrenergici nei pazienti con asma. In questo contesto, considerare i beta-bloccanti cardioselettivi, anche se dovrebbero essere somministrati con cautela.
Diuretici
Le alterazioni dell'ECG e/o l'ipokaliemia che possono derivare dalla somministrazione di diuretici non risparmiatori di potassio (come diuretici dell'ansa o tiazidici) possono essere gravemente peggiorate dai beta-agonisti, specialmente quando viene superata la dose raccomandata del beta-agonista. Sebbene il significato clinico di questi effetti non sia noto, si consiglia cautela nella co-somministrazione di beta-agonisti con diuretici non risparmiatori di potassio. Prendi in considerazione il monitoraggio dei livelli di potassio.
Digossina
Sono state dimostrate riduzioni medie del 16% e del 22% dei livelli sierici di digossina dopo somministrazione di una dose singola di salbutamolo per via endovenosa e orale, rispettivamente, a volontari normali che avevano ricevuto digossina per 10 giorni. Il significato clinico di questi risultati per i pazienti con malattia ostruttiva delle vie aeree che ricevono salbutamolo e digossina su base cronica non è chiaro. Tuttavia, sarebbe prudente valutare attentamente i livelli sierici di digossina nei pazienti che stanno attualmente assumendo digossina e aerosol per inalazione PROAIR HFA.
Inibitori della monoamino ossidasi o antidepressivi triciclici
PROAIR HFA aerosol per inalazione deve essere somministrato con estrema cautela ai pazienti in trattamento con inibitori delle monoaminossidasi o antidepressivi triciclici, o entro 2 settimane dall'interruzione di tali agenti, poiché l'azione dell'albuterolo sul sistema cardiovascolare può essere potenziata. Considerare una terapia alternativa nei pazienti che assumono inibitori delle MAO o antidepressivi triciclici.
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Broncospasmo paradosso
L'aerosol per inalazione PROAIR HFA può produrre broncospasmo paradossale che può essere pericoloso per la vita. Se si verifica broncospasmo paradosso, l'aerosol per inalazione PROAIR HFA deve essere interrotto immediatamente e deve essere istituita una terapia alternativa. Va riconosciuto che il broncospasmo paradosso, quando associato a formulazioni inalate, si verifica frequentemente con il primo utilizzo di un nuovo contenitore.
Deterioramento dell'asma
L'asma può peggiorare in modo acuto nell'arco di alcune ore o cronicamente nell'arco di diversi giorni o più. Se il paziente necessita di più dosi di PROAIR HFA aerosol per inalazione del normale, questo può essere un marker di destabilizzazione dell'asma e richiede una rivalutazione del paziente e del regime di trattamento, prestando particolare attenzione alla possibile necessità di un trattamento antinfiammatorio, ad es. corticosteroidi.
Uso di agenti antinfiammatori
L'uso di broncodilatatori beta-adrenergici-agonisti da soli potrebbe non essere adeguato per controllare l'asma in molti pazienti. Dovrebbe essere presa in considerazione tempestivamente l'aggiunta di agenti antinfiammatori, ad es. corticosteroidi, al regime terapeutico.
Effetti cardiovascolari
L'aerosol per inalazione PROAIR HFA, come altri beta-agonisti adrenergici, può produrre effetti cardiovascolari clinicamente significativi in alcuni pazienti misurati dalla frequenza cardiaca, dalla pressione sanguigna e/o dai sintomi. Sebbene tali effetti siano rari dopo la somministrazione di PROAIR HFA aerosol per inalazione alle dosi raccomandate, se si verificano, potrebbe essere necessario interrompere il farmaco. Inoltre, è stato riportato che i beta-agonisti producono alterazioni dell'ECG, come l'appiattimento dell'onda T, il prolungamento dell'intervallo QTc e la depressione del segmento ST. Il significato clinico di questi risultati è sconosciuto. Pertanto, l'aerosol per inalazione PROAIR HFA, come tutte le amine simpaticomimetiche, deve essere usato con cautela nei pazienti con disturbi cardiovascolari, in particolare insufficienza coronarica, aritmie cardiache e ipertensione.
Non superare la dose raccomandata
Sono stati segnalati decessi associati all'uso eccessivo di farmaci simpaticomimetici per via inalatoria in pazienti con asma. La causa esatta della morte è sconosciuta, ma si sospetta un arresto cardiaco a seguito di uno sviluppo inaspettato di una grave crisi asmatica acuta e di una successiva ipossia.
Reazioni di ipersensibilità immediata
Dopo la somministrazione di salbutamolo solfato possono verificarsi reazioni di ipersensibilità immediate, come dimostrato da rari casi di orticaria, angioedema, rash, broncospasmo, anafilassi ed edema orofaringeo. Il potenziale di ipersensibilità deve essere considerato nella valutazione clinica dei pazienti che manifestano reazioni di ipersensibilità immediate durante il trattamento con aerosol per inalazione PROAIR HFA.
Condizioni coesistenti
L'aerosol per inalazione PROAIR HFA, come tutte le amine simpaticomimetiche, deve essere usato con cautela nei pazienti con disturbi cardiovascolari, in particolare insufficienza coronarica, aritmie cardiache e ipertensione; in pazienti con disturbi convulsivi, ipertiroidismo o diabete mellito; e in pazienti che sono insolitamente responsivi alle amine simpaticomimetiche. Cambiamenti clinicamente significativi della pressione arteriosa sistolica e diastolica sono stati osservati in singoli pazienti e ci si può aspettare che si verifichino in alcuni pazienti dopo l'uso di qualsiasi broncodilatatore beta-adrenergico. È stato riportato che dosi elevate di salbutamolo per via endovenosa aggravano il diabete mellito e la chetoacidosi preesistenti.
Ipokaliemia
Come con altri beta-agonisti, l'aerosol per inalazione PROAIR HFA può produrre un'ipokaliemia significativa in alcuni pazienti, possibilmente attraverso lo shunt intracellulare, che ha il potenziale di produrre effetti cardiovascolari avversi. La diminuzione è solitamente transitoria, non richiede supplementazione.
Informazioni di consulenza per il paziente
Vedere Etichettatura del paziente approvata dalla FDA
Ai pazienti devono essere fornite le seguenti informazioni:
Frequenza d'uso
L'azione dell'aerosol per inalazione PROAIR HFA dovrebbe durare da 4 a 6 ore. Non utilizzare l'aerosol per inalazione PROAIR HFA più frequentemente di quanto raccomandato. Istruire i pazienti a non aumentare la dose o la frequenza delle dosi di PROAIR HFA aerosol per inalazione senza consultare il medico. Se i pazienti scoprono che il trattamento con l'aerosol per inalazione PROAIR HFA diventa meno efficace per il sollievo dei sintomi, i sintomi peggiorano e/o hanno bisogno di usare il prodotto più frequentemente del solito, devono consultare immediatamente un medico.
Adescamento e pulizia
Adescamento
L'adescamento è essenziale per garantire un contenuto di salbutamolo appropriato in ogni attuazione. Istruire i pazienti a preparare l'inalatore prima di usarlo per la prima volta e nei casi in cui l'inalatore non è stato utilizzato per più di 2 settimane rilasciando tre spruzzi nell'aria, lontano dal viso.
Pulizia
Per garantire un dosaggio corretto e prevenire il blocco dell'orifizio dell'attuatore, istruire i pazienti a lavare il boccaglio in plastica rossa dell'attuatore e ad asciugarlo accuratamente almeno una volta alla settimana. Informare i pazienti che, se hanno più di un inalatore PROAIR HFA, devono lavarli ciascuno a momenti separati per evitare di collegare la bomboletta sbagliata all'attuatore di plastica sbagliato. In questo modo, possono essere sicuri di conoscere sempre il numero corretto di dosi rimanenti. I pazienti devono essere istruiti a non collegare mai una bomboletta di medicinale da un altro inalatore all'attuatore PROAIR HFA e non collegare mai la bomboletta PROAIR HFA a un attuatore da qualsiasi altro inalatore. I pazienti non devono rimuovere il contenitore dall'attuatore se non durante la pulizia, poiché il riattacco può rilasciare una dose nell'aria e il contatore della dose eseguirà il conto alla rovescia ogni volta che viene rilasciato uno spray. Istruzioni dettagliate per la pulizia sono incluse nelle informazioni illustrate per il foglio illustrativo per il paziente.
Contadosi
pazienti devono essere informati che PROAIR HFA ha un contatore della dose collegato all'attuatore. Quando il paziente riceve l'inalatore, un punto nero apparirà nella finestra di visualizzazione fino a quando non sarà stato adescato 3 volte, a quel punto verrà visualizzato il numero 200. Il contatore della dose eseguirà il conto alla rovescia ogni volta che viene rilasciato uno spray. La finestra del contatore della dose mostra il numero di spray rimasti nell'inalatore in unità di due (ad es. 200, 198, 196, ecc.). Quando il contatore visualizza 20, il colore dei numeri cambierà in rosso per ricordare al paziente di contattare il farmacista per una ricarica di farmaci o di consultare il proprio medico per una ricarica di prescrizione. Quando il contatore della dose raggiunge lo 0, lo sfondo diventa rosso fisso. I pazienti devono essere informati di eliminare l'inalatore PROAIR HFA quando il contatore della dose mostra 0 o dopo la data di scadenza sul prodotto, a seconda di quale evento si verifica per primo.
Broncospasmo paradosso
Informare i pazienti che l'aerosol per inalazione PROAIR HFA può produrre broncospasmo paradosso. Invitare i pazienti a sospendere PROAIR HFA aerosol per inalazione se si verifica broncospasmo paradosso.
Uso concomitante di droghe
Mentre i pazienti stanno assumendo PROAIR HFA aerosol per inalazione, altri farmaci per via inalatoria e farmaci per l'asma devono essere assunti solo come indicato da un medico.
Eventi avversi comuni
Gli effetti avversi comuni del trattamento con salbutamolo per via inalatoria includono palpitazioni, dolore toracico, battito cardiaco accelerato, tremore o nervosismo.
Gravidanza
Le pazienti in gravidanza o in allattamento devono contattare il proprio medico in merito all'uso dell'aerosol per inalazione PROAIR HFA.
Esiste un registro dell'esposizione alla gravidanza che monitora gli esiti della gravidanza nelle donne esposte a farmaci per l'asma durante la gravidanza [vedi Utilizzare in popolazioni specifiche ].
Informazioni generali sull'uso
L'uso efficace e sicuro dell'aerosol per inalazione PROAIR HFA include la comprensione del modo in cui dovrebbe essere somministrato.
Agitare bene prima di ogni spruzzo.
Utilizzare l'aerosol per inalazione PROAIR HFA solo con l'attuatore fornito con il prodotto. Eliminare l'inalatore PROAIR HFA quando il contatore della dose mostra 0 o dopo la data di scadenza sul prodotto, a seconda di quale evento si verifica per primo. Non immergere mai il contenitore in acqua per determinare quanto è pieno il contenitore ("prova di galleggiamento").
In generale, la tecnica per somministrare l'aerosol per inalazione PROAIR HFA ai bambini è simile a quella per gli adulti. I bambini devono usare l'aerosol per inalazione PROAIR HFA sotto la supervisione di un adulto, secondo le istruzioni del medico del paziente.
Etichettatura del paziente approvata dalla FDA
Vedere lo strappo illustrato Informazioni per il paziente volantino.
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
In uno studio di 2 anni su ratti Sprague-Dawley, l'albuterolo solfato ha causato un aumento dose-correlato dell'incidenza di leiomiomi benigni del mesovarium a dosi dietetiche pari e superiori a 2 mg/kg (circa 15 volte e 6 volte la dose massima raccomandata nell'uomo dose giornaliera per inalazione (MRHDID) per adulti e bambini, rispettivamente, su base mg/m²). In un altro studio questo effetto è stato bloccato dalla co-somministrazione di propranololo, un antagonista beta-adrenergico non selettivo. In uno studio di 18 mesi su topi CD-1, l'albuterolo solfato non ha mostrato evidenza di tumorigenicità a dosi dietetiche fino a 500 mg/kg (circa 1.900 volte e 740 volte la MRHDID per adulti e bambini, rispettivamente, con un mg/m² base). In uno studio di 22 mesi su Golden Hamsters, l'albuterolo solfato non ha mostrato evidenza di tumorigenicità a dosi dietetiche fino a 50 mg/kg (circa 250 volte e 100 volte la MRHDID per adulti e bambini, rispettivamente, su base mg/m²) .
L'albuterol solfato non è risultato mutageno nel test di Ames o in un test di mutazione nel lievito. L'albuterolo solfato non è risultato clastogenico in un test sui linfociti periferici umani o in un test del micronucleo murino del ceppo AH1.
Gli studi sulla riproduzione nei ratti non hanno dimostrato evidenza di ridotta fertilità a dosi orali fino a 50 mg/kg (circa 380 volte la MRHDID per gli adulti su base mg/m²).
Utilizzare in popolazioni specifiche
Gravidanza
Registro dell'esposizione alla gravidanza
Esiste un registro dell'esposizione alla gravidanza che monitora gli esiti della gravidanza nelle donne esposte a farmaci per l'asma durante la gravidanza. Per ulteriori informazioni, contattare gli studi sulla gravidanza da madri a bambini condotti dall'Organizzazione degli specialisti dell'informazione in teratologia al numero 1-877-311-8972 o visitare http://mothertobaby.org/pregnancystudies/.
Riepilogo dei rischi
Non ci sono studi clinici randomizzati sull'uso di salbutamolo durante la gravidanza. I dati disponibili da studi epidemiologici pubblicati e case report post-marketing sugli esiti della gravidanza dopo l'uso di salbutamolo per via inalatoria non dimostrano in modo coerente un rischio di gravi difetti alla nascita o aborto spontaneo. Esistono considerazioni cliniche sull'uso dell'albuterolo nelle donne in gravidanza [vedi Considerazioni cliniche ]. Negli studi sulla riproduzione animale, quando l'albuterolo solfato è stato somministrato per via sottocutanea a topi gravidi, è stata rilevata la presenza di palatoschisi a una dose inferiore a e fino a 9 volte la dose massima giornaliera raccomandata per inalazione nell'uomo (MRHDID) [vedere Dati ].
Il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo per le popolazioni indicate non è noto. Nella popolazione generale degli Stati Uniti, il rischio stimato di gravi difetti alla nascita e di aborto spontaneo nelle gravidanze clinicamente riconosciute è rispettivamente del 2-4% e del 15-20%.
Considerazioni cliniche
Rischio materno e/o embrionale/fetale associato alla malattia
Nelle donne con asma scarsamente o moderatamente controllato, vi è un aumentato rischio di preeclampsia nella madre e prematurità, basso peso alla nascita e piccolo per l'età gestazionale nel neonato. Le donne in gravidanza devono essere attentamente monitorate e i farmaci adattati secondo necessità per mantenere un controllo ottimale.
Manodopera o consegna
A causa della potenziale interferenza dei beta-agonisti con la contrattilità uterina, l'uso dell'aerosol per inalazione PROAIR HFA per alleviare il broncospasmo durante il travaglio deve essere limitato a quei pazienti in cui i benefici superano chiaramente il rischio. L'aerosol per inalazione PROAIR HFA non è stato approvato per la gestione del travaglio pretermine. Reazioni avverse gravi, incluso edema polmonare, sono state riportate durante o dopo il trattamento del travaglio prematuro con beta2-agonisti, compreso l'albuterolo.
Dati
Dati sugli animali
In uno studio sulla riproduzione del topo, l'albuterolo solfato somministrato per via sottocutanea ha prodotto la formazione di palatoschisi in 5 su 111 (4,5%) feti a un'esposizione di nove decimi della MRHDID per gli adulti (su base mg/m² a una dose materna di 0,25 mg/kg ) e in 10 feti su 108 (9,3%) a circa 9 volte la MRHDID (su base mg/m² a una dose materna di 2,5 mg/kg). Effetti simili non sono stati osservati a circa un undicesimo della MRHDID per gli adulti (su base mg/m² a una dose materna di 0,025 mg/kg). La palatoschisi si è verificata anche in 22 su 72 (30,5%) feti di femmine trattate per via sottocutanea con isoproterenolo (controllo positivo).
In uno studio sulla riproduzione nel coniglio, l'albuterolo solfato somministrato per via orale ha indotto cranioschisi in 7 su 19 feti (37%) a circa 750 volte la MRHDID (su base mg/m² a una dose materna di 50 mg/kg).
In uno studio sulla riproduzione nel ratto, una formulazione di albuterol solfato/HFA-134a somministrata per inalazione non ha prodotto alcun effetto teratogeno a esposizioni circa 80 volte la MRHDID (su base mg/m² a una dose materna di 10,5 mg/kg).
Uno studio in cui a ratti gravidi è stato somministrato solfato di salbutamolo radiomarcato ha dimostrato che il materiale correlato al farmaco viene trasferito dalla circolazione materna al feto.
Allattamento
Riepilogo dei rischi
Non sono disponibili dati sulla presenza di salbutamolo nel latte umano, sugli effetti sul bambino allattato al seno o sugli effetti sulla produzione di latte. Tuttavia, i livelli plasmatici di salbutamolo dopo dosi terapeutiche inalate sono bassi nell'uomo e, se presente nel latte materno, l'albuterolo ha una bassa biodisponibilità orale [vedi FARMACOLOGIA CLINICA ].
I benefici per lo sviluppo e la salute dell'allattamento al seno dovrebbero essere considerati insieme al bisogno clinico di salbutamolo da parte della madre e a qualsiasi potenziale effetto avverso sul bambino allattato al seno da salbutamolo o dalla condizione materna sottostante.
Uso pediatrico
La sicurezza e l'efficacia di PROAIR HFA aerosol per inalazione per il trattamento o la prevenzione del broncospasmo nei bambini di età pari o superiore a 12 anni con malattia ostruttiva delle vie aeree reversibile si basa su uno studio clinico di 6 settimane in 116 pazienti di età pari o superiore a 12 anni con asma a confronto dosi di 180 mcg quattro volte al giorno con placebo e uno studio crossover a dose singola che ha confrontato dosi di 90, 180 e 270 mcg con placebo in 58 pazienti [vedere Studi clinici ]. La sicurezza e l'efficacia di PROAIR HFA aerosol per inalazione per il trattamento del broncospasmo indotto dall'esercizio nei bambini di età pari o superiore a 12 anni si basa su uno studio crossover a dose singola condotto su 24 adulti e adolescenti con broncospasmo indotto dall'esercizio che confronta dosi di 180 mcg con il placebo [vedere Studi clinici ].
La sicurezza dell'aerosol per inalazione di PROAIR HFA nei bambini di età compresa tra 4 e 11 anni si basa su uno studio clinico di 3 settimane condotto su 50 pazienti di età compresa tra 4 e 11 anni con asma, utilizzando la stessa formulazione di salbutarolo come in aerosol per inalazione di PROAIR HFA confrontando le dosi di 180 mcg quattro volte al giorno con placebo. L'efficacia di PROAIR HFA aerosol per inalazione nei bambini di età compresa tra 4 e 11 anni è estrapolata da studi clinici in pazienti di età pari o superiore a 12 anni con asma e broncospasmo indotto dall'esercizio, sulla base dei dati di uno studio a dose singola che confronta l'effetto broncodilatatore di PROAIR HFA 90 mcg e 180 mcg con placebo in 55 pazienti con asma e uno studio clinico di 3 settimane utilizzando la stessa formulazione di salbutamolo di PROAIR HFA aerosol per inalazione in 95 bambini asmatici di età compresa tra 4 e 11 anni confrontando una dose di 180 mcg di albuterolo quattro volte al giorno con placebo [vedi Studi clinici ].

La sicurezza e l'efficacia dell'aerosol per inalazione PROAIR HFA nei pazienti pediatrici di età inferiore ai 4 anni non sono state stabilite.
Uso geriatrico
Gli studi clinici sull'aerosol per inalazione PROAIR HFA non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso dai pazienti più giovani. Altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e quelli più giovani. In generale, la selezione della dose per un paziente anziano deve essere prudente, di solito iniziando dalla fascia bassa dell'intervallo di dosaggio, riflettendo la maggiore frequenza di ridotta funzionalità epatica, renale o cardiaca e di malattie concomitanti o altre terapie farmacologiche [vedere AVVERTENZE E PRECAUZIONI ].
È noto che tutti gli agonisti beta2-adrenergici, compreso l'albuterolo, sono sostanzialmente escreti dai reni e il rischio di reazioni tossiche può essere maggiore nei pazienti con funzionalità renale compromessa. Poiché i pazienti anziani hanno maggiori probabilità di avere una funzione renale ridotta, occorre prestare attenzione nella selezione della dose e può essere utile monitorare la funzione renale.
OVERDOSE
I sintomi attesi da sovradosaggio sono quelli di un'eccessiva stimolazione betaadrenergica e/o del verificarsi o dell'esagerazione di uno qualsiasi dei sintomi elencati in REAZIONI AVVERSE, ad es. convulsioni, angina, ipertensione o ipotensione, tachicardia con frequenze fino a 200 battiti al minuto, aritmie, nervosismo , mal di testa, tremore, secchezza delle fauci, palpitazioni, nausea, vertigini, affaticamento, malessere e insonnia.
Può verificarsi anche ipokaliemia. Come con tutti i farmaci simpaticomimetici, l'arresto cardiaco e persino la morte possono essere associati all'abuso dell'aerosol per inalazione PROAIR HFA.
Il trattamento consiste nell'interruzione di PROAIR HFA aerosol per inalazione insieme a un'appropriata terapia sintomatica. Può essere preso in considerazione l'uso giudizioso di un beta-bloccante cardioselettivo, tenendo presente che tale farmaco può produrre broncospasmo. Non ci sono prove sufficienti per determinare se la dialisi sia benefica per il sovradosaggio di PROAIR HFA Inalation Aerosol.
La dose letale mediana orale di albuterol solfato nei topi è maggiore di 2.000 mg/kg (circa 6.800 volte la dose massima giornaliera raccomandata per inalazione per gli adulti su base mg/m² e circa 3.200 volte la dose massima giornaliera raccomandata per inalazione per i bambini con una dose di /m² base). Nei ratti maturi, la dose letale mediana sottocutanea di albuterol solfato è di circa 450 mg/kg (circa 3.000 volte la dose massima giornaliera raccomandata per inalazione per gli adulti su base mg/m² e circa 1.400 volte la dose massima giornaliera raccomandata per inalazione per i bambini su una base mg/m²). Nei ratti giovani, la dose letale mediana per via sottocutanea è di circa 2.000 mg/kg (circa 14.000 volte la dose massima giornaliera raccomandata per inalazione per gli adulti su base mg/m² e circa 6.400 volte la dose massima giornaliera raccomandata per inalazione per i bambini su mg/m² base). La dose letale mediana per inalazione non è stata determinata negli animali.
CONTROINDICAZIONI
L'aerosol per inalazione PROAIR HFA è controindicato nei pazienti con una storia di ipersensibilità all'albuterolo e qualsiasi altro componente dell'aerosol per inalazione PROAIR HFA. Dopo l'uso di salbutamolo solfato sono stati riportati rari casi di reazioni di ipersensibilità, inclusi orticaria, angioedema ed eruzioni cutanee [vedi AVVERTENZE E PRECAUZIONI ].
FARMACOLOGIA CLINICA
Meccanismo di azione
L'albuterolo solfato è un beta 2-agonista adrenergico. Gli effetti farmacologici dell'albuterolo solfato sono attribuibili all'attivazione dei recettori beta 2-adrenergici sulla muscolatura liscia delle vie aeree. L'attivazione dei recettori beta2-adrenergici porta all'attivazione dell'adenilciclasi e ad un aumento della concentrazione intracellulare di 3', 5'-adenosina monofosfato ciclico (AMP ciclico). Questo aumento dell'AMP ciclico è associato all'attivazione della protein chinasi A, che a sua volta inibisce la fosforilazione della miosina e abbassa le concentrazioni intracellulari di calcio ionico, con conseguente rilassamento muscolare. L'albuterolo rilassa la muscolatura liscia di tutte le vie aeree, dalla trachea ai bronchioli terminali. L'albuterolo agisce come un antagonista funzionale per rilassare le vie aeree indipendentemente dallo spasmogeno coinvolto, proteggendo così da tutti i broncocostrittori. L'aumento delle concentrazioni di AMP ciclico è anche associato all'inibizione del rilascio di mediatori dai mastociti nelle vie aeree. Sebbene sia riconosciuto che i recettori beta2adrenergici sono i recettori predominanti sulla muscolatura liscia bronchiale, i dati indicano che ci sono recettori beta nel cuore umano, dal 10% al 50% dei quali sono recettori beta2adrenergici cardiaci. La precisa funzione di questi recettori non è stata stabilita [vedi AVVERTENZE E PRECAUZIONI ].
Nella maggior parte degli studi clinici controllati è stato dimostrato che l'albuterolo ha un effetto maggiore sul tratto respiratorio, sotto forma di rilassamento della muscolatura liscia bronchiale, rispetto all'isoproterenolo a dosi comparabili, producendo meno effetti cardiovascolari. Tuttavia, l'albuterolo per via inalatoria, come altri farmaci agonisti beta-adrenergici, può produrre un effetto cardiovascolare significativo in alcuni pazienti, misurato dalla frequenza cardiaca, dalla pressione sanguigna, dai sintomi e/o dai cambiamenti elettrocardiografici [vedi AVVERTENZE E PRECAUZIONI ].
Farmacocinetica
livelli sistemici di salbutamolo sono bassi dopo l'inalazione delle dosi raccomandate. In uno studio incrociato condotto su volontari sani maschi e femmine, dosi cumulative elevate di PROAIR HFA Inhalation Aerosol (1.080 mcg di albuterolo base somministrati in un'ora) hanno prodotto concentrazioni plasmatiche di picco medie (Cmax) ed esposizione sistemica (AUCinf) di circa 4.100 pg/ mL e 28.426 pg/mL*ora, rispettivamente rispetto a circa 3.900 pg/mL e 28.395 pg/mL*ora, rispettivamente a seguito della stessa dose di un comparatore inalatore attivo di salbutamolo HFA-134a. L'emivita plasmatica terminale dell'albuterolo erogato dall'aerosol per inalazione PROAIR HFA è stata di circa 6 ore. Il confronto dei parametri farmacocinetici non ha mostrato differenze tra i prodotti.
Il profilo farmacocinetico di PROAIR HFA Inhalation Aerosol è stato valutato in uno studio incrociato a due vie su 11 volontari sani pediatrici, di età compresa tra 4 e 11 anni. Una singola somministrazione di PROAIR HFA aerosol per inalazione (180 mcg di salbutarolo base) ha prodotto una Cmax e una AUC0-∞ media dei minimi quadrati (SE) rispettivamente di 1.100 (1,18) pg/mL e 5.120 (1,15) pg/mL*ora. L'emivita plasmatica terminale media dei minimi quadrati (SE) dell'albuterolo erogato dall'aerosol per inalazione PROAIR HFA è stata di 166 (7,8) minuti.
Metabolismo ed eliminazione
Le informazioni disponibili nella letteratura pubblicata suggeriscono che il principale enzima responsabile del metabolismo dell'albuterolo nell'uomo sia SULTIA3 (sulfotransferasi). Quando l'albuterolo racemico è stato somministrato per via endovenosa o per inalazione dopo la somministrazione orale di carbone, c'era una differenza da 3 a 4 volte nell'area sotto le curve concentrazione-tempo tra gli enantiomeri (R)-e (S)albuterolo, con (S )-concentrazioni di albumerolo costantemente più elevate. Tuttavia, senza pretrattamento con carbone, dopo somministrazione orale o inalatoria le differenze erano da 8 a 24 volte, suggerendo che l'(R)-albuterolo è metabolizzato preferenzialmente nel tratto gastrointestinale, presumibilmente da SULTIA3.
La principale via di eliminazione dell'albuterolo è attraverso l'escrezione renale (dall'80% al 100%) del composto originario o del metabolita primario. Meno del 20% del farmaco viene rilevato nelle feci. Dopo somministrazione endovenosa di salbutamolo racemico, tra il 25% e il 46% della frazione (R)-albuterolo della dose è stata escreta come (R)-albuterolo immodificato nelle urine.
Compromissione geriatrica, pediatrica, epatica/renale
Non sono stati condotti studi di farmacocinetica per PROAIR HFA aerosol per inalazione su neonati o anziani.
L'effetto dell'insufficienza epatica sulla farmacocinetica di PROAIR HFA Inhalation Aerosol non è stato valutato.
L'effetto dell'insufficienza renale sulla farmacocinetica dell'albuterolo è stato valutato in 5 soggetti con clearance della creatinina compresa tra 7 e 53 ml/min e i risultati sono stati confrontati con quelli di volontari sani. La malattia renale non ha avuto alcun effetto sull'emivita, ma si è verificata una riduzione del 67% della clearance dell'albuterolo. Si deve usare cautela quando si somministrano dosi elevate di PROAIR HFA aerosol per inalazione a pazienti con insufficienza renale [vedi Utilizzare in popolazioni specifiche ].
Tossicologia animale e/o farmacologia
Preclinico
Studi endovenosi nei ratti con albuterol solfato hanno dimostrato che l'albuterolo attraversa la barriera ematoencefalica e raggiunge concentrazioni cerebrali pari a circa il 5% delle concentrazioni plasmatiche. Nelle strutture al di fuori della barriera ematoencefalica (ghiandole pineale e pituitaria), le concentrazioni di salbutarolo sono risultate 100 volte quelle dell'intero cervello.
Studi su animali da laboratorio (maialini, roditori e cani) hanno dimostrato l'insorgenza di aritmie cardiache e morte improvvisa (con evidenza istologica di necrosi miocardica) quando β-agonisti e metilxantine sono stati somministrati contemporaneamente. Il significato clinico di questi risultati è sconosciuto.
Il propellente HFA-134a è privo di attività farmacologica tranne che a dosi molto elevate negli animali (380 -1300 volte l'esposizione umana massima basata sul confronto dei valori di AUC), producendo principalmente atassia, tremori, dispnea o salivazione. Questi sono simili agli effetti prodotti dai clorofluorocarburi strutturalmente correlati (CFC), che sono stati ampiamente utilizzati negli inalatori a dosaggio prescritto.
Negli animali e nell'uomo, il propellente HFA-134a è stato rapidamente assorbito ed eliminato, con un'emivita di eliminazione di 3-27 minuti negli animali e di 5-7 minuti nell'uomo. Il tempo alla concentrazione plasmatica massima (Tmax) e il tempo medio di residenza sono entrambi estremamente brevi e portano a una comparsa transitoria di HFA-134a nel sangue senza evidenza di accumulo.
Studi clinici
Broncospasmo associato all'asma
Pazienti adulti e adolescenti di età pari o superiore a 12 anni
In uno studio randomizzato, in doppio cieco, controllato con placebo della durata di 6 settimane, PROAIR HFA Inhalation Aerosol (58 pazienti) è stato confrontato con un placebo HFA aerosol per inalazione abbinato (58 pazienti) in pazienti asmatici di età compresa tra 12 e 76 anni a una dose di 180 mcg di salbutamolo quattro volte al giorno. È stato incluso un braccio con inalatore di salbutamolo HFA-134a (56 pazienti) commercializzato in cieco con il comparatore attivo HFA-134a.
Le misurazioni seriali del FEV1, mostrate di seguito come variazione percentuale rispetto al basale del giorno del test al giorno 1 e al giorno 43, hanno dimostrato che due inalazioni di aerosol per inalazione PROAIR HFA hanno prodotto un miglioramento significativamente maggiore del FEV1 rispetto al valore pretrattamento rispetto al placebo abbinato, nonché un effetto broncodilatatore paragonabile al comparatore attivo commercializzato HFA-134a inalatore di salbutamolo.
FEV1 come variazione percentuale media rispetto alla pre-dose del giorno del test in un giorno 1 della sperimentazione clinica di 6 settimane
INFORMAZIONI PER IL PAZIENTE
PROAIR® HFA (pro' ar) (albuterol solfato) Inalazione Aerosol
Leggere queste informazioni per il paziente prima di iniziare a utilizzare PROAIR HFA e ogni volta che si riceve una ricarica. Potrebbero esserci nuove informazioni. Queste informazioni non sostituiscono il parlare con il medico delle tue condizioni mediche o del tuo trattamento.
Cos'è PROAIR HFA?
PROAIR HFA è un medicinale soggetto a prescrizione utilizzato nelle persone di età pari o superiore a 4 anni per:
- trattare o prevenire il broncospasmo nelle persone che hanno una malattia ostruttiva delle vie aeree reversibile
- prevenire il broncospasmo indotto dall'esercizio
Non è noto se PROAIR HFA sia sicuro ed efficace nei bambini di età inferiore ai 4 anni.
Chi non dovrebbe usare PROAIR HFA?
Non utilizzare PROAIR HFA se sono allergici all'albuterolo solfato o ad uno qualsiasi degli eccipienti di PROAIR HFA. Vedere la fine di questo foglio illustrativo per un elenco completo degli ingredienti di PROAIR HFA.
Cosa devo dire al mio medico prima di usare PROAIR HFA?
Prima di usare PROAIR HFA informi il medico se:
- avere problemi cardiaci
- ha la pressione alta (ipertensione)
- avere convulsioni (convulsioni)
- ha problemi alla tiroide
- avere il diabete
- ha bassi livelli di potassio nel sangue
- sono incinta o stanno pianificando una gravidanza. Non è noto se PROAIR HFA possa danneggiare il feto. Si rivolga al medico se è incinta o sta pianificando una gravidanza.
- stanno allattando o pianificano di allattare. Non è noto se PROAIR HFA passi nel latte materno. Parlate con il vostro medico del modo migliore per nutrire il vostro bambino se state usando PROAIR HFA.
Informa il tuo medico di tutti i medicinali che prendi, compresi medicinali soggetti a prescrizione e senza prescrizione medica, vitamine e integratori a base di erbe.
PROAIR HFA e altri medicinali possono influenzarsi a vicenda e causare effetti collaterali. PROAIR HFA può influenzare il modo in cui agiscono altri medicinali e altri medicinali possono influenzare il modo in cui agisce PROAIR HFA.
In particolare informi il medico se assume:
- altri medicinali per via inalatoria o medicinali per l'asma
- medicinali beta-bloccanti
- diuretici
- digossina
- inibitori delle monoaminossidasi
- antidepressivi triciclici
Chieda al medico o al farmacista un elenco di questi medicinali se ha dei dubbi.
Conosci le medicine che prendi. Tienine un elenco da mostrare al medico e al farmacista quando ricevi un nuovo medicinale.
Come devo usare PROAIR HFA?
- Per istruzioni dettagliate, vedere "Istruzioni per l'uso" alla fine di queste Informazioni sul paziente.
- Usa PROAIR HFA esattamente come ti dice il tuo medico.
- Se tuo figlio ha bisogno di usare PROAIR HFA, osservalo attentamente per assicurarti che usi correttamente l'inalatore. Il medico le mostrerà come suo figlio dovrebbe usare PROAIR HFA.
- Ciascuna dose di PROAIR HFA dovrebbe durare da 4 ore a 6 ore.
- Non aumenti la dose o prenda dosi extra di PROAIR HFA senza prima parlarne con il medico.
- Rivolgiti immediatamente a un medico se PROAIR HFA non aiuta più i tuoi sintomi.
- Rivolgiti immediatamente a un medico se i tuoi sintomi peggiorano o se hai bisogno di usare l'inalatore più spesso.
- Durante l'uso di PROAIR HFA, non usi altri medicinali di salvataggio per via inalatoria e medicinali per l'asma a meno che il medico non le dica di farlo.
- Chiama il tuo medico se i sintomi dell'asma come dispnea e difficoltà respiratorie peggiorano nel giro di poche ore o giorni. Il medico potrebbe aver bisogno di prescriverle un altro medicinale (ad esempio corticosteroidi) per trattare i sintomi.
Quali sono i possibili effetti collaterali di PROAIR HFA?
PROAIR HFA può causare gravi effetti collaterali, tra cui:
- peggioramento difficoltà respiratorie, tosse e respiro sibilante (broncospasmo paradossale). Se ciò accade, interrompa l'uso di PROAIR HFA e chiami il medico o richieda immediatamente un'assistenza di emergenza. È più probabile che si verifichi un broncospasmo paradosso con il primo utilizzo di un nuovo contenitore di medicinale.
- problemi cardiaci tra cui battito cardiaco accelerato e pressione sanguigna più alta
- possibile morte nelle persone con asma che usano troppo PROAIR HFA
- reazioni allergiche. Chiama subito il medico se hai i seguenti sintomi di una reazione allergica:
- pelle pruriginosa
- gonfiore sotto la pelle o in gola
- eruzione cutanea
- peggioramento dei problemi di respirazione
- bassi livelli di potassio nel sangue
- peggioramento di altri problemi medici nelle persone che usano anche PROAIR HFA, compreso l'aumento della glicemia
Gli effetti collaterali più comuni di PROAIR HFA includono:
- il tuo cuore sembra battere o correre (palpitazioni)
- dolore al petto
- battito cardiaco accelerato
- tremore
- nervosismo
- male alla testa
- vertigini
- mal di gola
- rinorrea
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di PROAIR HFA. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
Come devo conservare PROAIR HFA?
- Conservare PROAIR HFA a temperatura ambiente tra 15° C e 25° C (59° F e 77° F).
- Evitare l'esposizione a caldo e freddo estremi.
- Agitare bene il contenitore PROAIR HFA prima dell'uso.
- Non forare il contenitore PROAIR HFA.
- Non conservare la bomboletta PROAIR HFA vicino a fonti di calore o fiamme. Temperature superiori a 120 ° F possono causare l'esplosione del contenitore.
- Non gettare la bomboletta PROAIR HFA nel fuoco o in un inceneritore.
- Evitare di spruzzare PROAIR HFA negli occhi.
Tenere PROAIR HFA e tutti i medicinali fuori dalla portata dei bambini.
Informazioni generali sull'uso sicuro ed efficace di PROAIR HFA
Talvolta i medicinali vengono prescritti per scopi diversi da quelli elencati in una Guida ai farmaci. Non utilizzare PROAIR HFA per una condizione per la quale non è stato prescritto. Non somministrare PROAIR HFA ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Queste informazioni per il paziente riepilogano le informazioni più importanti su PROAIR HFA. Se desideri maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo farmacista o medico informazioni su PROAIR HFA che è scritto per gli operatori sanitari.
Per ulteriori informazioni, visitare il sito Web www.ProAirHFA.com o chiamare il numero 1-888-482-9522.
Quali sono gli ingredienti di PROAIR HFA?
Ingrediente attivo: solfato di salbuta
Ingredienti inattivi: propellente HFA-134a ed etanolo.
Istruzioni per l'uso
PROAIR® HFA (pro' ar) (albuterol solfato) Inalazione Aerosol
Leggere queste Istruzioni per l'uso prima di iniziare a utilizzare PROAIR HFA e ogni volta che si riceve una ricarica. Potrebbero esserci nuove informazioni. Queste informazioni non sostituiscono il parlare con il medico delle tue condizioni mediche o del tuo trattamento.
I componenti dell'inalatore PROAIR HFA:
Ci sono 2 parti principali del tuo dispositivo inalatore PROAIR HFA, tra cui:
- attuatore in plastica rossa che spruzza il medicinale dal contenitore. Vedi figura A.
- cappuccio protettivo antipolvere che copre il boccaglio dell'attuatore. Vedi figura A.
C'è anche un contenitore di metallo che contiene la medicina. Vedi figura A.
C'è anche un contatore della dose fissato sul retro dell'attuatore con una finestra di visualizzazione che mostra quanti spray di medicinale sono rimasti. Vedi figura B.
Vedrai un punto nero nella finestra di visualizzazione sull'attuatore fino a quando il dispositivo non è stato adescato 3 volte. Vedere la Figura B e "Adescamento del dispositivo PROAIR HFA" di seguito.
Figura A e Figura B 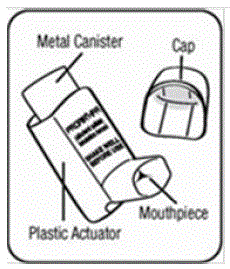
- Non utilizzare l'attuatore PROAIR HFA con un contenitore di medicinale di qualsiasi altro inalatore.
- Non utilizzare una bomboletta PROAIR HFA con un attuatore di qualsiasi altro inalatore, incluso un altro inalatore PROAIR HFA.
Adescamento del dispositivo PROAIR HFA:
Il tuo dispositivo PROAIR deve essere innescato prima di usarlo per la prima volta o se il tuo dispositivo non è stato utilizzato per più di 14 giorni consecutivi. Non adescare il tuo dispositivo PROAIR HFA ogni giorno.
- Estrarre il dispositivo PROAIR HFA dalla confezione.
- Rimuovere il cappuccio protettivo antipolvere dal boccaglio.
- Agitare bene l'inalatore e spruzzarlo nell'aria lontano dal viso. Vedi figura C.
Figura C 
- Agitare e spruzzare l'inalatore in questo modo altre 2 volte per completare l'adescamento. Il contatore della dose sull'attuatore dovrebbe visualizzare il numero 200 dopo aver adescato l'attuatore per la prima volta. Vedi figura D.
Figura D 
Ogni volta che utilizzi il tuo dispositivo PROAIR HFA:
- Assicurarsi che il contenitore si adatti saldamente all'attuatore di plastica.
- Guarda nel boccaglio per assicurarti che non ci siano oggetti estranei, soprattutto se il cappuccio non è stato utilizzato per coprire il boccaglio.
Lettura del contatore della dose sull'attuatore PROAIR HFA
- Il contatore della dose eseguirà il conto alla rovescia ogni volta che viene rilasciato uno spray. La finestra del contatore della dose mostra il numero di erogazioni rimaste nell'inalatore in unità di 2 erogazioni. Ad esempio, sono rimasti 190 spray se la freccia è esattamente opposta al numero 190, o 189 spray rimasti se la freccia punta tra 190 e 188. Vedere la figura D.
- Quando il contatore della dose raggiunge lo 0, continuerà a mostrare 0 e dovresti sostituire il dispositivo PROAIR HFA.
- Il contatore della dose non può essere azzerato ed è permanentemente collegato all'attuatore. Non modificare mai i numeri del contatore della dose né toccare il perno all'interno dell'attuatore.
- Non rimuovere il contenitore dall'attuatore in plastica tranne durante la pulizia. Riattaccare il contenitore all'attuatore può rilasciare accidentalmente una dose di PROAIR HFA nell'aria. Il contatore della dose eseguirà il conto alla rovescia ogni volta che viene rilasciato uno spray.
Utilizzo del dispositivo PROAIR HFA:
Passo 1. Agitare bene l'inalatore prima di ogni spruzzo. Rimuovere il cappuccio dal boccaglio dell'attuatore.
Passaggio 2. Tenere l'inalatore con il boccaglio rivolto verso il basso. Vedi figura E.
Figura E 
Passaggio 3. Espira attraverso la bocca e spingi quanta più aria possibile dai tuoi polmoni. Metti il boccaglio in bocca e chiudi le labbra attorno ad esso. Vedi figura F.
Passaggio 4. Spingi la parte superiore del contenitore fino in fondo mentre inspiri profondamente e lentamente attraverso la bocca. Vedi figura F.
Figura F 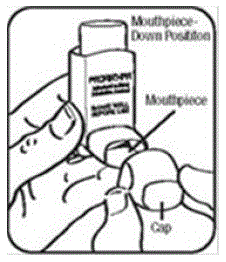
Passaggio 5. Subito dopo la fuoriuscita dello spray, togli il dito dal contenitore. Dopo aver inspirato completamente, togli l'inalatore dalla bocca e chiudi la bocca.
Passaggio 6. Trattieni il respiro il più a lungo possibile, fino a 10 secondi, quindi respirare normalmente.
Se il medico le ha detto di usare più spray, attendere 1 minuto e agitare di nuovo l'inalatore. Ripetere i passaggi da 2 a 6.
Passaggio 7. Rimetti il cappuccio sul boccaglio dopo ogni utilizzo dell'inalatore. Assicurati che il cappuccio scatti saldamente in posizione.
Pulizia del dispositivo PROAIR HFA:
È molto importante mantenere pulito l'attuatore in plastica in modo che il medicinale non si accumuli e blocchi lo spray. Vedere la figura G e la figura H.
Figura G e Figura H 
- Non cercare di pulire il contenitore di metallo o lasciarlo bagnare. L'inalatore potrebbe smettere di spruzzare se non viene pulito correttamente.
- Se si dispone di più di 1 inalatore PROAIR HFA, lavare ciascun dispositivo in momenti separati per evitare di mettere la bomboletta sbagliata insieme all'attuatore di plastica sbagliato. In questo modo puoi essere certo di conoscere sempre il numero corretto di dosi rimanenti di PROAIR HFA.
- Lavare l'attuatore almeno 1 volta a settimana come segue:
- Estrarre il contenitore dall'attuatore e togliere il cappuccio dal boccaglio.
- Tenere l'attuatore sotto il rubinetto e far scorrere acqua calda attraverso di esso per circa 30 secondi. Vedi figura I.
Figura I 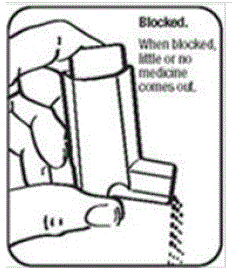
- Capovolgere l'attuatore e far scorrere acqua calda attraverso il boccaglio per circa 30 secondi. Vedi figura J.
Figura J 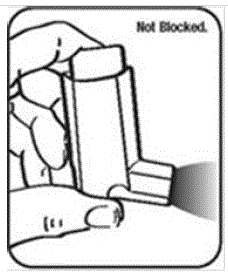
- Scuotere quanta più acqua possibile dall'attuatore. Guarda nel boccaglio per assicurarti che qualsiasi accumulo di medicinale sia stato completamente lavato via. In caso di accumuli, ripetere le istruzioni di lavaggio.
- Lascia che l'attuatore si asciughi completamente all'aria, ad esempio durante la notte. Vedi figura K.
Figura K 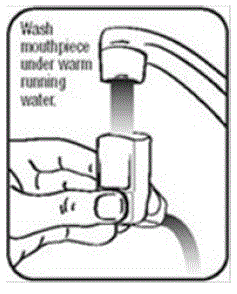
- Quando l'attuatore è asciutto, inserire il contenitore nell'attuatore e assicurarsi che si adatti saldamente. Agitare bene l'inalatore e spruzzarlo due volte nell'aria lontano dal viso. Rimetti il cappuccio sul boccaglio.
Se è necessario utilizzare l'inalatore prima che l'attuatore sia completamente asciutto:
- Scuotere quanta più acqua possibile dall'attuatore.
- Metti il contenitore nell'attuatore e assicurati che si adatti saldamente.
- Agitare bene l'inalatore e spruzzarlo due volte nell'aria lontano dal viso.
- Prenda la dose di PROAIR HFA come prescritto.
- Seguire le istruzioni di pulizia sopra.
Sostituzione del dispositivo PROAIR HFA
- Quando il contatore della dose sull'attuatore indica il numero 20, il colore dei numeri cambierà in rosso. I numeri rossi servono a ricordarti di ricaricare la tua prescrizione o di chiedere al tuo medico un'altra prescrizione per PROAIR HFA. Quando il contatore della dose raggiunge lo 0, il colore di sfondo cambia in rosso fisso.
- Getti via l'inalatore PROAIR HFA non appena il contatore della dose indica 0 o dopo la data di scadenza sulla confezione di PROAIR HFA, a seconda di quale evento si verifica per primo. Non dovresti continuare a usare l'inalatore dopo 200 nebulizzazioni anche se il contenitore potrebbe non essere completamente vuoto. Non puoi essere sicuro di ricevere qualsiasi medicinale dopo aver usato 200 spray.
- Non utilizzare l'inalatore dopo la data di scadenza sulla confezione di PROAIR HFA.
Queste informazioni per il paziente e istruzioni per l'uso sono state approvate dalla Food and Drug Administration statunitense.
