Zetia 10mg Ezetimibe Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Cos'è Zetia e come si usa?
Zetia è un medicinale su prescrizione usato per trattare i sintomi del colesterolo alto e per ridurre il colesterolo. Zetia può essere usato da solo o con altri farmaci.
Zetia appartiene a una classe di farmaci chiamati agenti ipolipemizzanti, 2-azetidinoni.
Non è noto se Zetia 10 mg sia sicuro ed efficace nei bambini di età inferiore ai 10 anni.
Quali sono i possibili effetti collaterali di Zetia?
Zetia può causare gravi effetti collaterali tra cui:
- dolore muscolare,
- dolorabilità o debolezza muscolare,
- febbre,
- stanchezza insolita, e
- urina di colore scuro
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Zetia 10mg includono:
- dolori muscolari o articolari,
- naso tappato,
- dolore al seno,
- mal di gola,
- diarrea, e
- dolore a un braccio o una gamba
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Zetia. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
ZETIA (ezetimibe) fa parte di una classe di composti ipolipemizzanti che inibiscono selettivamente l'assorbimento intestinale del colesterolo e dei fitosteroli correlati. Il nome chimico di ezetimibe è 1-(4-fluorofenil)-3(R)-[3-(4-fluorofenil)-3(S)-idrossipropil]-4(S)-(4-idrossifenil)-2-azetidinone . La formula empirica è C24H21F2NO3. Il suo peso molecolare è 409,4 e la sua formula strutturale è:
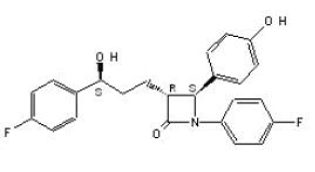
Ezetimibe è una polvere cristallina bianca che è liberamente o molto solubile in etanolo, metanolo e acetone e praticamente insolubile in acqua. Ezetimibe ha un punto di fusione di circa 163°C ed è stabile a temperatura ambiente. ZETIA 10 mg è disponibile sotto forma di compressa per somministrazione orale contenente 10 mg di ezetimibe e i seguenti eccipienti: croscarmellosa sodica NF, lattosio monoidrato NF, magnesio stearato NF, cellulosa microcristallina NF, povidone USP e sodio lauril solfato NF.
INDICAZIONI
La terapia con agenti ipolipemizzanti dovrebbe essere solo una componente dell'intervento con fattori di rischio multipli in soggetti a rischio significativamente aumentato di malattia vascolare aterosclerotica dovuta all'ipercolesterolemia. La terapia farmacologica è indicata in aggiunta alla dieta quando la risposta a una dieta a basso contenuto di grassi saturi e colesterolo e ad altre misure non farmacologiche da sole è stata inadeguata.
Iperlipidemia primaria
Monoterapia
ZETIA®, somministrato da solo, è indicato come terapia aggiuntiva alla dieta per la riduzione del colesterolo totale elevato (C-totale), del colesterolo lipoproteico a bassa densità (C-LDL), dell'apolipoproteina B (Apo B) e del colesterolo lipoproteico non ad alta densità (non-HDL-C) in pazienti con iperlipidemia primaria (eterozigote familiare e non familiare).
Terapia combinata con inibitori della HMG-CoA reduttasi (statine)
ZETIA 10 mg, somministrato in combinazione con un inibitore della 3-idrossi-3-metilglutaril-coenzima A (HMG-CoA) reduttasi (statina), è indicato come terapia aggiuntiva alla dieta per la riduzione di livelli elevati di C, LDL e Apo. B e non-HDL-C in pazienti con iperlipidemia primaria (eterozigote familiare e non familiare).
Terapia Combinata Con Fenofibrato
ZETIA 10 mg, somministrato in associazione con fenofibrato, è indicato come terapia aggiuntiva alla dieta per la riduzione di livelli elevati di C totale, LDL, Apo B e C non HDL in pazienti adulti con iperlipidemia mista.
Ipercolesterolemia Familiare Omozigote (HoFH)
La combinazione di ZETIA 10 mg e atorvastatina o simvastatina è indicata per la riduzione dei livelli elevati di C totale e di C-LDL nei pazienti con HoFH, in aggiunta ad altri trattamenti ipolipemizzanti (p. es., aferesi LDL) o se tali trattamenti non sono disponibili .
Sitosterolemia omozigote
ZETIA 10 mg è indicato come terapia aggiuntiva alla dieta per la riduzione dei livelli elevati di sitosterolo e campesterolo in pazienti con sitosterolemia familiare omozigote.
Limitazioni d'uso
L'effetto di ZETIA sulla morbilità e mortalità cardiovascolare non è stato determinato.
ZETIA non è stato studiato nelle dislipidemie di Fredrickson di tipo I, III, IV e V.
DOSAGGIO E SOMMINISTRAZIONE
Informazioni generali sul dosaggio
La dose raccomandata di ZETIA è di 10 mg una volta al giorno.
ZETIA 10 mg può essere somministrato con o senza cibo.
Terapia ipolipemizzante concomitante
ZETIA 10 mg può essere somministrato con una statina (in pazienti con iperlipidemia primaria) o con fenofibrato (in pazienti con iperlipidemia mista) per un effetto incrementale. Per comodità, la dose giornaliera di ZETIA può essere assunta contemporaneamente alla statina o al fenofibrato, secondo le raccomandazioni posologiche per i rispettivi farmaci.
Coadminis con sequestranti degli acidi biliari
La somministrazione di ZETIA deve avvenire ≥2 ore prima o ≥4 ore dopo la somministrazione di un sequestrante degli acidi biliari [vedere INTERAZIONI DI DROGA ].
Pazienti con insufficienza epatica
Non è necessario alcun aggiustamento della dose nei pazienti con lieve insufficienza epatica [vedi AVVERTENZE E PRECAUZIONI ].
Pazienti con insufficienza renale
Non è necessario alcun aggiustamento del dosaggio nei pazienti con insufficienza renale [vedi FARMACOLOGIA CLINICA ]. Quando somministrato con simvastatina in pazienti con insufficienza renale da moderata a grave (velocità di filtrazione glomerulare stimata Utilizzare in popolazioni specifiche ].
Pazienti geriatrici
Non è necessario alcun aggiustamento del dosaggio nei pazienti geriatrici [vedi FARMACOLOGIA CLINICA ].
COME FORNITO
Forme di dosaggio e punti di forza
Le compresse da 10 mg sono compresse a forma di capsula di colore da bianco a biancastro, con impresso “414” su un lato.
Stoccaggio e manipolazione
N. 3861 - Compresse ZETIA, 10 mg , sono compresse a forma di capsula di colore da bianco a biancastro, con impresso “414” su un lato. Sono forniti come segue:
NDC 66582-414-31 bottiglie da 30 NDC 66582-414-54 bottiglie da 90 NDC 66582-414-74 bottiglie da 500 NDC 66582-414-76 bottiglie da 5000 NDC 66582-414-28 confezioni monodose da 100.
Magazzinaggio
Conservare a 25°C (77°F); escursioni consentite a 15-30°C (59-86°F). [Vedere Temperatura ambiente controllata USP .] Proteggere dall'umidità.
Merck Sharp & Dohme Corp., una consociata di MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revisionato: agosto 2013
EFFETTI COLLATERALI
Le seguenti reazioni avverse gravi sono discusse in modo più dettagliato in altre sezioni dell'etichetta:
- Anomalie degli enzimi epatici [vedi AVVERTENZE E PRECAUZIONI ]
- Rabdomiolisi e miopatia [vedi AVVERTENZE E PRECAUZIONI ]
Studi di monoterapia
Nel database degli studi clinici controllati ZETIA 10 mg (controllato con placebo) di 2396 pazienti con una durata mediana del trattamento di 12 settimane (intervallo da 0 a 39 settimane), il 3,3% dei pazienti trattati con ZETIA 10 mg e il 2,9% dei pazienti trattati con placebo hanno interrotto il trattamento a causa di eventi avversi reazioni. Le reazioni avverse più comuni nel gruppo di pazienti trattati con ZETIA 10 mg che hanno portato all'interruzione del trattamento e che si sono verificate a un tasso maggiore rispetto al placebo sono state:
- Artralgia (0,3%)
- Vertigini (0,2%)
- Aumento della gamma-glutamiltransferasi (0,2%)
Le reazioni avverse più comunemente riportate (incidenza ≥2% e maggiore rispetto al placebo) nel database degli studi clinici controllati in monoterapia ZETIA su 2396 pazienti sono state: infezione delle vie respiratorie superiori (4,3%), diarrea (4,1%), artralgia (3,0%), sinusite (2,8%) e dolore alle estremità (2,7%).
Studi sulla cosomministrazione di statine
Nel database degli studi clinici controllati con ZETIA + statina di 11.308 pazienti con una durata mediana del trattamento di 8 settimane (intervallo da 0 a 112 settimane), il 4,0% dei pazienti in trattamento con ZETIA + statina e il 3,3% dei pazienti in trattamento con statina da sola ha interrotto il trattamento a causa di reazioni avverse. Le reazioni avverse più comuni nel gruppo di pazienti trattati con ZETIA + statina che hanno portato all'interruzione del trattamento e che si sono verificate a un tasso maggiore rispetto alla sola statina sono state:
- Aumento dell'alanina aminotransferasi (0,6%)
- Mialgia (0,5%)
- Stanchezza, aumento dell'aspartato aminotransferasi, mal di testa e dolore alle estremità (ciascuno allo 0,2%)
Le reazioni avverse più comunemente riportate (incidenza ≥2% e maggiore della sola statina) nel database degli studi clinici controllati da ZETIA + statine su 11.308 pazienti sono state: nasofaringite (3,7%), mialgia (3,2%), infezione delle vie respiratorie superiori (2,9% ), artralgia (2,6%) e diarrea (2,5%).
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni molto variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica clinica.
Monoterapia
In 10 studi clinici in doppio cieco, controllati con placebo, 2396 pazienti con iperlipidemia primaria (fascia di età 9-86 anni, 50% donne, 90% caucasici, 5% neri, 3% ispanici, 2% asiatici) e livelli elevati di C-LDL sono stati trattati con ZETIA 10 mg/die per una durata mediana del trattamento di 12 settimane (intervallo da 0 a 39 settimane).
Le reazioni avverse riportate in ≥2% dei pazienti trattati con ZETIA e con un'incidenza maggiore del placebo negli studi controllati con placebo su ZETIA 10 mg, indipendentemente dalla valutazione della causalità, sono mostrate nella Tabella 1.
TABELLA 1: Reazioni avverse cliniche che si verificano in ≥2% dei pazienti trattati con ZETIA 10 mg e con un'incidenza maggiore del placebo, indipendentemente dalla causalità
La frequenza delle reazioni avverse meno comuni era comparabile tra ZETIA 10 mg e placebo.
Combinazione con una statina
In 28 studi clinici in doppio cieco, controllati (con placebo o con controllo attivo), 11.308 pazienti con iperlipidemia primaria (fascia di età 10-93 anni, 48% donne, 85% caucasici, 7% neri, 4% ispanici, 3% asiatici) e LDL-C elevati sono stati trattati con ZETIA 10 mg/die in concomitanza o in aggiunta alla terapia con statine in corso per una durata mediana del trattamento di 8 settimane (intervallo da 0 a 112 settimane).
L'incidenza di un aumento consecutivo delle transaminasi (≥3 × ULN) è stata maggiore nei pazienti trattati con ZETIA 10 mg somministrato con statine (1,3%) rispetto ai pazienti trattati con sole statine (0,4%). [Vedere AVVERTENZE E PRECAUZIONI ]
Le reazioni avverse cliniche riportate in ≥2% dei pazienti trattati con ZETIA + statina e con un'incidenza maggiore rispetto alla statina, indipendentemente dalla valutazione della causalità, sono mostrate nella Tabella 2.
TABELLA 2: Reazioni avverse cliniche che si verificano in ≥2% dei pazienti trattati con ZETIA 10 mg somministrato in concomitanza con una statina e con un'incidenza maggiore della statina, indipendentemente dalla causalità
Combinazione con Fenofibrato
Questo studio clinico ha coinvolto 625 pazienti con dislipidemia mista (fascia di età 20-76 anni, 44% donne, 79% caucasici, 0,1% neri, 11% ispanici, 5% asiatici) trattati per un massimo di 12 settimane e 576 pazienti trattati per un massimo di altre 48 settimane hanno valutato la co-somministrazione di ZETIA e fenofibrato. Questo studio non è stato progettato per confrontare i gruppi di trattamento per eventi rari. I tassi di incidenza (IC al 95%) per aumenti clinicamente importanti (≥3 — ULN, consecutivi) dei livelli di transaminasi epatica erano del 4,5% (1,9; 8,8) e del 2,7% (1,2; 5,4) per la monoterapia con fenofibrato (n=188) e ZETIA co-somministrato rispettivamente con fenofibrato (n=183), aggiustati per l'esposizione al trattamento. I tassi di incidenza corrispondenti per la colecistectomia erano rispettivamente dello 0,6% (IC al 95%: 0,0%, 3,1%) e dell'1,7% (IC al 95%: 0,6%, 4,0%) per la monoterapia con fenofibrato e ZETIA 10 mg somministrato in concomitanza con fenofibrato [vedere INTERAZIONI DI DROGA ]. Il numero di pazienti esposti alla terapia di somministrazione concomitante e alla monoterapia con fenofibrato ed ezetimibe era inadeguato per valutare il rischio di malattia della cistifellea. Non ci sono stati aumenti di CPK > 10 — ULN in nessuno dei gruppi di trattamento.
Esperienza post marketing
Poiché le reazioni seguenti sono riportate volontariamente da una popolazione di dimensioni incerte, generalmente non è possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco.
Le seguenti reazioni avverse aggiuntive sono state identificate durante l'uso successivo all'approvazione di ZETIA:
Reazioni di ipersensibilità, inclusi anafilassi, angioedema, rash e orticaria; eritema multiforme; artralgia; mialgia; creatinfosfochinasi elevata; miopatia/rabdomiolisi [vedi AVVERTENZE E PRECAUZIONI ]; aumenti delle transaminasi epatiche; epatite; dolore addominale; trombocitopenia; pancreatite; nausea; vertigini; parestesia; depressione; male alla testa; colelitiasi; colecistite.
INTERAZIONI DI DROGA
[Vedere FARMACOLOGIA CLINICA ]
Ciclosporina
Si deve usare cautela quando si usa ZETIA 10 mg e ciclosporina in concomitanza a causa dell'aumentata esposizione sia a ezetimibe che a ciclosporina. Le concentrazioni di ciclosporina devono essere monitorate nei pazienti che ricevono ZETIA e ciclosporina.
Il grado di aumento dell'esposizione a ezetimibe può essere maggiore nei pazienti con grave insufficienza renale. Nei pazienti trattati con ciclosporina, i potenziali effetti dell'aumentata esposizione a ezetimibe derivante dall'uso concomitante devono essere attentamente valutati rispetto ai benefici delle alterazioni dei livelli lipidici forniti da ezetimibe.
Fibrati
L'efficacia e la sicurezza della co-somministrazione di ezetimibe con fibrati diversi dal fenofibrato non sono state studiate.
I fibrati possono aumentare l'escrezione di colesterolo nella bile, portando alla colelitiasi. In uno studio preclinico sui cani, ezetimibe ha aumentato il colesterolo nella bile della cistifellea [vedi Tossicologia non clinica ]. La somministrazione concomitante di ZETIA con fibrati diversi dal fenofibrato non è raccomandata fino a quando l'uso nei pazienti non sarà adeguatamente studiato.
fenofibrato
Se si sospetta colelitiasi in un paziente che riceve ZETIA 10 mg e fenofibrato, sono indicati studi sulla cistifellea e deve essere presa in considerazione una terapia ipolipemizzante alternativa [vedere REAZIONI AVVERSE e l'etichettatura del prodotto per il fenofibrato].
colestiramina
La somministrazione concomitante di colestiramina ha ridotto l'area media sotto la curva (AUC) dell'ezetimibe totale di circa il 55%. La riduzione incrementale del C-LDL dovuta all'aggiunta di ezetimibe alla colestiramina può essere ridotta da questa interazione.
Anticoagulanti cumarinici
Se ezetimibe viene aggiunto al warfarin, un anticoagulante cumarinico, l'International Normalized Ratio (INR) deve essere adeguatamente monitorato.
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Utilizzare con statine o fenofibrato
La somministrazione concomitante di ZETIA con una statina o fenofibrato specifico deve essere conforme all'etichettatura del prodotto per quel farmaco.
Enzimi epatici
In studi clinici controllati in monoterapia, l'incidenza di aumenti consecutivi (≥3 x il limite superiore della norma [ULN]) dei livelli di transaminasi epatica era simile tra ZETIA (0,5%) e placebo (0,3%).
In studi clinici controllati di combinazione di ZETIA 10 mg iniziato in concomitanza con una statina, l'incidenza di aumenti consecutivi (≥3 x ULN) dei livelli di transaminasi epatica è stata dell'1,3% per i pazienti trattati con ZETIA somministrato con statine e dello 0,4% per i pazienti trattati con sole statine. Questi aumenti delle transaminasi erano generalmente asintomatici, non associati a colestasi e tornavano ai valori basali dopo l'interruzione della terapia o con il proseguimento del trattamento. Quando ZETIA viene somministrato in concomitanza con una statina, gli esami del fegato devono essere eseguiti all'inizio della terapia e secondo le raccomandazioni della statina. Se persiste un aumento di ALT o AST ≥3 x ULN, considerare la sospensione di ZETIA 10 mg e/o della statina.
Miopatia/rabdomiolisi
Negli studi clinici, non è stato riscontrato un eccesso di miopatia o rabdomiolisi associata a ZETIA 10 mg rispetto al braccio di controllo pertinente (placebo o statina da sole). Tuttavia, miopatia e rabdomiolisi sono reazioni avverse note alle statine e ad altri farmaci ipolipemizzanti. Negli studi clinici, l'incidenza della creatinfosfochinasi (CPK) > 10 x ULN è stata dello 0,2% per ZETIA rispetto allo 0,1% per il placebo e dello 0,1% per ZETIA somministrato in concomitanza con una statina rispetto allo 0,4% per le sole statine. Il rischio di tossicità del muscolo scheletrico aumenta con dosi più elevate di statina, età avanzata (> 65 anni), ipotiroidismo, insufficienza renale e, a seconda della statina utilizzata, con l'uso concomitante di altri farmaci.
Nell'esperienza post-marketing con ZETIA sono stati segnalati casi di miopatia e rabdomiolisi. La maggior parte dei pazienti che hanno sviluppato rabdomiolisi stavano assumendo una statina prima di iniziare ZETIA. Tuttavia, è stata segnalata rabdomiolisi con ZETIA 10 mg in monoterapia e con l'aggiunta di ZETIA 10 mg ad agenti noti per essere associati ad un aumentato rischio di rabdomiolisi, come i fibrati. ZETIA e qualsiasi statina o fibrato che il paziente sta assumendo in concomitanza devono essere immediatamente sospesi se viene diagnosticata o sospettata una miopatia. La presenza di sintomi muscolari e un livello di CPK > 10 volte l'ULN indica miopatia.
Insufficienza epatica
A causa degli effetti sconosciuti dell'aumentata esposizione a ezetimibe in pazienti con insufficienza epatica da moderata a grave, ZETIA non è raccomandato in questi pazienti. [Vedere FARMACOLOGIA CLINICA ]
Informazioni di consulenza per il paziente
Vedere Etichettatura del paziente approvata dalla FDA (INFORMAZIONI PER IL PAZIENTE).
pazienti devono essere avvisati di aderire alla loro dieta raccomandata dal National Cholesterol Education Program (NCEP), un programma di esercizio fisico regolare e test periodici di un pannello lipidico a digiuno.
Dolore muscolare
Tutti i pazienti che iniziano la terapia con ezetimibe devono essere informati del rischio di miopatia e devono essere informati di segnalare tempestivamente qualsiasi dolore muscolare, dolorabilità o debolezza inspiegabili. Il rischio che ciò si verifichi aumenta quando si assumono determinati tipi di farmaci. I pazienti dovrebbero discutere tutti i farmaci, sia da prescrizione che da banco, con il proprio medico.
Enzimi epatici
I test epatici devono essere eseguiti quando ZETIA 10 mg viene aggiunto alla terapia con statine e secondo le raccomandazioni sulle statine.
Gravidanza
Le donne in età fertile devono essere informate di utilizzare un metodo efficace di controllo delle nascite per prevenire la gravidanza durante l'utilizzo di ZETIA in aggiunta alla terapia con statine. Discuti i piani di gravidanza futuri con le tue pazienti e discuti quando interrompere la terapia combinata ZETIA 10 mg e statine se stanno cercando di concepire. Le pazienti devono essere informate che in caso di gravidanza devono interrompere l'assunzione di ZETIA 10 mg di combinazione e la terapia con statine e chiamare il proprio medico.
Allattamento al seno
Le donne che allattano al seno devono essere informate di non usare ZETIA in aggiunta alla terapia con statine. Le pazienti che hanno un disturbo lipidico e stanno allattando al seno devono essere avvisate di discutere le opzioni con i loro operatori sanitari.
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Uno studio di cancerogenicità alimentare di 104 settimane con ezetimibe è stato condotto nei ratti a dosi fino a 1500 mg/kg/giorno (maschi) e 500 mg/kg/giorno (femmine) (~20 volte l'esposizione umana a 10 mg al giorno in base all'AUC0 -24 ore per l'ezetimibe totale). Uno studio di cancerogenicità alimentare di 104 settimane con ezetimibe è stato condotto anche nei topi a dosi fino a 500 mg/kg/giorno (> 150 volte l'esposizione umana a 10 mg al giorno sulla base dell'AUC0-24 ore per l'ezetimibe totale). Non ci sono stati aumenti statisticamente significativi nell'incidenza del tumore nei ratti o nei topi trattati con farmaci.
Nessuna evidenza di mutagenicità è stata osservata in vitro in un test di mutagenicità microbica (Ames) con Salmonella typhimurium ed Escherichia coli con o senza attivazione metabolica. Nessuna evidenza di clastogenicità è stata osservata in vitro in un test di aberrazione cromosomica nei linfociti del sangue periferico umano con o senza attivazione metabolica. Inoltre, non c'era evidenza di genotossicità nel test in vivo del micronucleo di topo.
Negli studi sulla fertilità orale (gavage) di ezetimibe condotti nei ratti, non vi è stata evidenza di tossicità riproduttiva a dosi fino a 1000 mg/kg/die nei ratti maschi o femmine (~7 volte l'esposizione umana a 10 mg al giorno sulla base dell'AUC0- 24 ore per l'ezetimibe totale).
Utilizzare in popolazioni specifiche
Gravidanza
Gravidanza Categoria C
Non ci sono studi adeguati e ben controllati sull'ezetimibe nelle donne in gravidanza. Ezetimibe deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il rischio per il feto.
Negli studi sullo sviluppo embrio-fetale orale (gavage) di ezetimibe condotti su ratti e conigli durante l'organogenesi, non sono emerse evidenze di effetti embrioletali alle dosi testate (250, 500, 1000 mg/kg/giorno). Nei ratti, è stata osservata una maggiore incidenza di reperti scheletrici fetali comuni (paio extra di costole toraciche, centro vertebrale cervicale non ossificato, costole accorciate) a 1000 mg/kg/giorno (~10 volte l'esposizione umana a 10 mg al giorno in base all'AUC0-24 ore per ezetimibe totale). Nei conigli trattati con ezetimibe, è stata osservata un'incidenza aumentata di costole extra toraciche a 1000 mg/kg/die (150 volte l'esposizione umana a 10 mg al giorno sulla base dell'AUC0-24 ore per ezetimibe totale). Ezetimibe ha attraversato la placenta quando a ratti e conigli gravidi sono state somministrate dosi orali multiple.
Studi a dosi multiple di ezetimibe somministrato in combinazione con statine in ratti e conigli durante l'organogenesi determinano esposizioni più elevate a ezetimibe e statine. I risultati riproduttivi si verificano a dosi inferiori nella terapia di associazione rispetto alla monoterapia.
Tutte le statine sono controindicate nelle donne in gravidanza e in allattamento. Quando ZETIA 10 mg viene somministrato con una statina in una donna in età fertile, fare riferimento alla categoria di gravidanza e all'etichettatura del prodotto per la statina. [Vedi CONTROINDICAZIONI]
Madri che allattano
Non è noto se ezetimibe venga escreto nel latte materno umano. Negli studi sui ratti, l'esposizione all'ezetimibe totale nei cuccioli che allattavano era fino alla metà di quella osservata nel plasma materno. Poiché molti farmaci vengono escreti nel latte materno, occorre prestare attenzione quando ZETIA 10 mg viene somministrato a una donna che allatta. ZETIA non deve essere utilizzato nelle madri che allattano a meno che il potenziale beneficio non giustifichi il potenziale rischio per il neonato.
Uso pediatrico
Gli effetti di ZETIA co-somministrato con simvastatina (n=126) rispetto alla simvastatina in monoterapia (n=122) sono stati valutati in ragazzi e ragazze adolescenti con ipercolesterolemia familiare eterozigote (HeFH). In uno studio multicentrico, in doppio cieco, controllato seguito da una fase in aperto, 142 ragazzi e 106 ragazze postmenarcali, di età compresa tra 10 e 17 anni (età media 14,2 anni, 43% femmine, 82% caucasici, 4% asiatici, 2% neri , 13% multietnico) con HeFH sono stati randomizzati a ricevere ZETIA 10 mg in concomitanza con simvastatina o simvastatina in monoterapia. L'inclusione nello studio richiedeva 1) un livello di C-LDL basale compreso tra 160 e 400 mg/dL e 2) un'anamnesi e una presentazione clinica coerenti con HeFH. Il valore medio di C-LDL basale era 225 mg/dL (intervallo: 161-351 mg/dL) nel gruppo ZETIA 10 mg somministrato in concomitanza con il gruppo simvastatina rispetto a 219 mg/dL (intervallo: 149-336 mg/dL) nel gruppo simvastatina in monoterapia gruppo. I pazienti hanno ricevuto ZETIA e simvastatina (10 mg, 20 mg o 40 mg) o simvastatina in monoterapia (10 mg, 20 mg o 40 mg) per 6 settimane, ZETIA e simvastatina 40 mg o simvastatina 40 mg in monoterapia per nelle 27 settimane successive e la somministrazione concomitante in aperto di ZETIA e simvastatina (10 mg, 20 mg o 40 mg) per le 20 settimane successive.
risultati dello studio alla settimana 6 sono riassunti nella Tabella 3. I risultati alla settimana 33 erano coerenti con quelli alla settimana 6.
TABELLA 3: Differenza percentuale media alla settimana 6 tra il pool di ZETIA 10 mg somministrato in concomitanza con il gruppo Simvastatina e il gruppo in monoterapia con Simvastatina in pool in pazienti adolescenti con ipercolesterolemia familiare eterozigote
Dall'inizio dello studio alla fine della settimana 33, le interruzioni dovute a una reazione avversa si sono verificate in 7 (6%) pazienti nel gruppo ZETIA somministrato in concomitanza con simvastatina e in 2 (2%) pazienti nel gruppo in monoterapia con simvastatina.
Durante lo studio, si sono verificati aumenti delle transaminasi epatiche (due misurazioni consecutive per ALT e/o AST ≥3 x ULN) in quattro (3%) individui nel gruppo ZETIA 10 mg somministrato in concomitanza con simvastatina e in due (2%) individui in monoterapia con simvastatina gruppo. Aumenti di CPK (≥10 x ULN) si sono verificati in due (2%) individui nel gruppo ZETIA somministrato in concomitanza con il gruppo simvastatina e in zero individui nel gruppo in monoterapia con simvastatina.
In questo studio controllato limitato, non vi è stato alcun effetto significativo sulla crescita o sulla maturazione sessuale nei ragazzi o nelle ragazze adolescenti, o sulla durata del ciclo mestruale nelle ragazze.
La co-somministrazione di ZETIA 10 mg con simvastatina a dosi superiori a 40 mg/die non è stata studiata negli adolescenti. Inoltre, ZETIA 10 mg non è stato studiato in pazienti di età inferiore a 10 anni o in ragazze premenarcali.
Sulla base dell'ezetimibe totale (ezetimibe + ezetimibe-glucuronide), non ci sono differenze farmacocinetiche tra adolescenti e adulti. Non sono disponibili dati di farmacocinetica nella popolazione pediatrica
Uso geriatrico
Studi di monoterapia
Dei 2396 pazienti che hanno ricevuto ZETIA 10 mg negli studi clinici, 669 (28%) avevano 65 anni e più e 111 (5%) avevano 75 anni e più.
Studi sulla cosomministrazione di statine
Degli 11.308 pazienti che hanno ricevuto ZETIA + statina negli studi clinici, 3587 (32%) avevano 65 anni e più e 924 (8%) avevano 75 anni e più.
Non sono state osservate differenze complessive in termini di sicurezza ed efficacia tra questi pazienti e i pazienti più giovani e altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e quelli più giovani, ma non può essere esclusa una maggiore sensibilità di alcuni individui più anziani [vedi FARMACOLOGIA CLINICA ].

Insufficienza renale
Se utilizzato in monoterapia, non è necessario alcun aggiustamento del dosaggio di ZETIA 10 mg.
Nello studio Study of Heart and Renal Protection (SHARP) su 9270 pazienti con insufficienza renale da moderata a grave (6247 pazienti non in dialisi con creatinina sierica mediana 2,5 mg/dL e velocità di filtrazione glomerulare mediana stimata 25,6 ml/min/1,73 m² e 3023 pazienti in dialisi), l'incidenza di eventi avversi gravi, eventi avversi che hanno portato all'interruzione del trattamento in studio o eventi avversi di particolare interesse (eventi avversi muscoloscheletrici, anomalie degli enzimi epatici, cancro incidente) è stata simile tra i pazienti mai assegnati a ezetimibe 10 mg più simvastatina 20 mg (n=4650) o placebo (n=4620) durante un follow-up mediano di 4,9 anni. Tuttavia, poiché l'insufficienza renale è un fattore di rischio per la miopatia associata a statine, dosi di simvastatina superiori a 20 mg devono essere utilizzate con cautela e un attento monitoraggio quando somministrate in concomitanza con ZETIA in pazienti con insufficienza renale da moderata a grave.
Insufficienza epatica
ZETIA non è raccomandato nei pazienti con insufficienza epatica da moderata a grave [vedi AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ].
ZETIA 10 mg somministrato in concomitanza con una statina è controindicato nei pazienti con malattia epatica attiva o aumenti persistenti inspiegabili dei livelli delle transaminasi epatiche [vedere CONTROINDICAZIONI ; AVVERTENZE E PRECAUZIONI e FARMACOLOGIA CLINICA ].
OVERDOSE
Negli studi clinici, somministrazione di ezetimibe, 50 mg/die a 15 soggetti sani per un massimo di 14 giorni, 40 mg/die a 18 pazienti con iperlipidemia primaria per un massimo di 56 giorni e 40 mg/die a 27 pazienti con sitosterolemia omozigote per 26 settimane è stata generalmente ben tollerata. Una paziente di sesso femminile con sitosterolemia omozigote ha assunto un sovradosaggio accidentale di ezetimibe 120 mg/die per 28 giorni senza che siano stati riportati eventi avversi clinici o di laboratorio.
In caso di sovradosaggio, devono essere adottate misure sintomatiche e di supporto.
CONTROINDICAZIONI
ZETIA è controindicato nelle seguenti condizioni:
- La combinazione di ZETIA 10 mg con una statina è controindicata nei pazienti con malattia epatica attiva o aumenti persistenti inspiegabili dei livelli delle transaminasi epatiche.
- Donne in gravidanza o che potrebbero rimanere incinte. Poiché le statine riducono la sintesi del colesterolo e possibilmente la sintesi di altre sostanze biologicamente attive derivate dal colesterolo, ZETIA in combinazione con una statina può causare danni al feto se somministrato a donne in gravidanza. Inoltre, non vi è alcun beneficio apparente alla terapia durante la gravidanza e la sicurezza nelle donne in gravidanza non è stata stabilita. Se la paziente rimane incinta durante l'assunzione di questo farmaco, la paziente deve essere informata del potenziale rischio per il feto e della mancanza di benefici clinici noti con l'uso continuato durante la gravidanza. [Vedere Utilizzare in popolazioni specifiche ]
- Madri che allattano. Poiché le statine possono passare nel latte materno e poiché le statine possono potenzialmente causare gravi reazioni avverse nei lattanti, le donne che necessitano di un trattamento con ZETIA in combinazione con una statina devono essere avvisate di non allattare i loro bambini [vedi Utilizzare in popolazioni specifiche ].
- Pazienti con nota ipersensibilità a qualsiasi componente di questo prodotto. Con ZETIA sono state riportate reazioni di ipersensibilità inclusi anafilassi, angioedema, rash e orticaria [vedere REAZIONI AVVERSE ].
FARMACOLOGIA CLINICA
Meccanismo di azione
Ezetimibe riduce il colesterolo nel sangue inibendo l'assorbimento del colesterolo da parte dell'intestino tenue. In uno studio clinico di 2 settimane su 18 pazienti ipercolesterolemici, ZETIA 10 mg ha inibito l'assorbimento intestinale del colesterolo del 54% rispetto al placebo. ZETIA non ha avuto effetti clinicamente significativi sulle concentrazioni plasmatiche delle vitamine liposolubili A, D ed E (in uno studio su 113 pazienti) e non ha alterato la produzione di ormone steroideo corticosurrenale (in uno studio su 118 pazienti).
Il contenuto di colesterolo nel fegato deriva principalmente da tre fonti. Il fegato può sintetizzare il colesterolo, assorbire il colesterolo dal sangue dalle lipoproteine circolanti o assorbire il colesterolo assorbito dall'intestino tenue. Il colesterolo intestinale è derivato principalmente dal colesterolo secreto nella bile e dal colesterolo alimentare.
Ezetimibe ha un meccanismo d'azione diverso da quello di altre classi di composti che riducono il colesterolo (statine, sequestranti degli acidi biliari [resine], derivati dell'acido fibrico e stanoli vegetali). È stato dimostrato che il bersaglio molecolare di ezetimibe è il trasportatore di steroli, Niemann-Pick C1-Like 1 (NPC1L1), che è coinvolto nell'assorbimento intestinale di colesterolo e fitosteroli.
Ezetimibe non inibisce la sintesi del colesterolo nel fegato, né aumenta l'escrezione di acidi biliari. Invece, l'ezetimibe si localizza al bordo della spazzola dell'intestino tenue e inibisce l'assorbimento del colesterolo, portando a una diminuzione dell'apporto di colesterolo intestinale al fegato. Ciò provoca una riduzione delle riserve di colesterolo epatico e un aumento della clearance del colesterolo dal sangue; questo distinto meccanismo è complementare a quello delle statine e del fenofibrato [vedi Studi clinici ].
Farmacodinamica
Studi clinici hanno dimostrato che livelli elevati di C-totale, LDL-C e Apo B, il principale costituente proteico delle LDL, promuovono l'aterosclerosi umana. Inoltre, i livelli ridotti di HDL-C sono associati allo sviluppo dell'aterosclerosi. Studi epidemiologici hanno stabilito che la morbilità e la mortalità cardiovascolare variano direttamente con il livello di C-totale e di C-LDL e inversamente con il livello di C-HDL. Come l'LDL, anche le lipoproteine ricche di trigliceridi arricchite di colesterolo, comprese le lipoproteine a densità molto bassa (VLDL), le lipoproteine a densità intermedia (IDL) e i resti, possono promuovere l'aterosclerosi. L'effetto indipendente dell'aumento del colesterolo HDL o della riduzione del TG sul rischio di morbilità e mortalità coronarica e cardiovascolare non è stato determinato.
ZETIA riduce il C totale, il C-LDL, l'Apo B, il C non HDL e il TG e aumenta il C-HDL nei pazienti con iperlipidemia. La somministrazione di ZETIA 10 mg con una statina è efficace nel migliorare il C totale sierico, il C-LDL, l'Apo B, il C-non-HDL, il TG e il C-HDL oltre a entrambi i trattamenti da soli. La somministrazione di ZETIA 10 mg con fenofibrato è efficace nel migliorare il C totale sierico, il C-LDL, l'Apo B e il C non HDL nei pazienti con iperlipidemia mista rispetto a entrambi i trattamenti da soli. Non sono stati stabiliti gli effetti di ezetimibe somministrato da solo o in aggiunta a una statina o fenofibrato sulla morbilità e mortalità cardiovascolare.
Farmacocinetica
Assorbimento
Dopo somministrazione orale, ezetimibe viene assorbito e ampiamente coniugato a un glucuronide fenolico farmacologicamente attivo (ezetimibe-glucuronide). Dopo una singola dose di 10 mg di ZETIA 10 mg in adulti a digiuno, le concentrazioni plasmatiche di picco (Cmax) medie di ezetimibe da 3,4 a 5,5 ng/mL sono state raggiunte entro 4-12 ore (Tmax). I valori medi di Cmax di ezetimibe-glucuronide compresi tra 45 e 71 ng/mL sono stati raggiunti tra 1 e 2 ore (Tmax). Non vi è stata alcuna deviazione sostanziale dalla proporzionalità della dose tra 5 e 20 mg. Non è possibile determinare la biodisponibilità assoluta di ezetimibe, poiché il composto è praticamente insolubile in mezzi acquosi adatti per l'iniezione.
Effetto del cibo sull'assorbimento orale
La somministrazione concomitante di cibo (pasti ricchi di grassi o senza grassi) non ha avuto effetto sull'entità dell'assorbimento di ezetimibe quando somministrato sotto forma di compresse di ZETIA da 10 mg. Il valore C di ezetimibe è stato aumentato del 38% con il consumo di pasti ricchi di grassi. ZETIA può essere somministrato con o senza cibo.
Distribuzione
Ezetimibe ed ezetimibe-glucuronide sono altamente legati (> 90%) alle proteine plasmatiche umane.
Metabolismo ed escrezione
Ezetimibe viene metabolizzato principalmente nell'intestino tenue e nel fegato tramite coniugazione con glucuronide (una reazione di fase II) con successiva escrezione biliare e renale. In tutte le specie valutate è stato osservato un metabolismo ossidativo minimo (una reazione di fase I).
Nell'uomo, l'ezetimibe viene rapidamente metabolizzato in ezetimibe-glucuronide. L'ezetimibe e l'ezetimibeglucuronide sono i principali composti derivati dal farmaco rilevati nel plasma, costituendo rispettivamente circa il 10-20% e l'80-90% del farmaco totale nel plasma. Sia ezetimibe che ezetimibe-glucuronide vengono eliminati dal plasma con un'emivita di circa 22 ore sia per ezetimibe che per ezetimibeglucuronide. I profili di concentrazione plasmatica-tempo mostrano picchi multipli, suggerendo un riciclo enteroepatico.
Dopo somministrazione orale di 14C-ezetimibe (20 mg) a soggetti umani, l'ezetimibe totale (ezetimibe + ezetimibe-glucuronide) rappresentava circa il 93% della radioattività totale nel plasma. Dopo 48 ore, non c'erano livelli rilevabili di radioattività nel plasma.
Circa il 78% e l'11% della radioattività somministrata è stata ritrovata nelle feci e nelle urine, rispettivamente, in un periodo di raccolta di 10 giorni. L'ezetimibe era il componente principale nelle feci e rappresentava il 69% della dose somministrata, mentre l'ezetimibe-glucuronide era il componente principale nelle urine e rappresentava il 9% della dose somministrata.
Popolazioni specifiche
Pazienti geriatrici: In uno studio a dosi multiple con ezetimibe somministrato a 10 mg una volta al giorno per 10 giorni, le concentrazioni plasmatiche di ezetimibe totale erano circa 2 volte superiori nei soggetti sani più anziani (≥65 anni) rispetto ai soggetti più giovani.
Pazienti pediatrici: [Vedere Utilizzare in popolazioni specifiche ]
Genere: In uno studio a dosi multiple con ezetimibe somministrato a 10 mg una volta al giorno per 10 giorni, le concentrazioni plasmatiche di ezetimibe totale erano leggermente superiori (
Gara: Sulla base di una meta-analisi di studi farmacocinetici a dosi multiple, non sono emerse differenze farmacocinetiche tra soggetti neri e caucasici. Studi su soggetti asiatici hanno indicato che la farmacocinetica di ezetimibe era simile a quella osservata nei soggetti caucasici.
Insufficienza epatica: Dopo una singola dose di 10 mg di ezetimibe, l'AUC media di ezetimibe totale è aumentata di circa 1,7 volte nei pazienti con compromissione epatica lieve (punteggio Child-Pugh da 5 a 6), rispetto ai soggetti sani. I valori medi dell'AUC per ezetimibe totale ed ezetimibe sono aumentati rispettivamente di circa 3-4 volte e da 5 a 6 volte, nei pazienti con compromissione epatica moderata (punteggio Child-Pugh da 7 a 9) o grave (punteggio Child-Pugh da 10 a 15). In uno studio di 14 giorni a dosi multiple (10 mg al giorno) in pazienti con compromissione epatica moderata, i valori medi dell'AUC per ezetimibe ed ezetimibe totali sono aumentati di circa 4 volte il giorno 1 e il giorno 14 rispetto ai soggetti sani. A causa degli effetti sconosciuti dell'aumentata esposizione a ezetimibe in pazienti con compromissione epatica moderata o grave, ZETIA non è raccomandato in questi pazienti [vedere AVVERTENZE E PRECAUZIONI ].
Insufficienza renale: Dopo una singola dose di 10 mg di ezetimibe in pazienti con malattia renale grave (n=8; CrCl media ≥ 30 ml/min/1,73 m²), i valori medi di AUC per ezetimibe totale, ezetimibe-glucuronide ed ezetimibe sono aumentati di circa 1,5 -fold, rispetto ai soggetti sani (n=9).
Interazioni farmacologiche
[Guarda anche INTERAZIONI DI DROGA ]
ZETIA 10 mg non ha avuto effetti significativi su una serie di farmaci sonda (caffeina, destrometorfano, tolbutamide e midazolam IV) noti per essere metabolizzati dal citocromo P450 (1A2, 2D6, 2C8/9 e 3A4) in uno studio "cocktail" su dodici soggetti sani maschi adulti. Ciò indica che l'ezetimibe non è né un inibitore né un induttore di questi isoenzimi del citocromo P450 ed è improbabile che l'ezetimibe influisca sul metabolismo dei farmaci metabolizzati da questi enzimi.
TABELLA 4: Effetto della somministrazione concomitante di farmaci sull'ezetimibe totale
TABELLA 5: Effetto della somministrazione concomitante di Ezetimibe sull'esposizione sistemica ad altri farmaci
Tossicologia animale e/o farmacologia
L'effetto ipocolesterolemico di ezetimibe è stato valutato in scimmie Rhesus, cani, ratti e modelli murini alimentati con colesterolo del metabolismo del colesterolo umano. È stato riscontrato che Ezetimibe ha un valore ED50 di 0,5 μg/kg/giorno per inibire l'aumento dei livelli di colesterolo plasmatico nelle scimmie. I valori di ED50 in cani, ratti e topi erano rispettivamente di 7, 30 e 700 μg/kg/giorno. Questi risultati sono coerenti con ZETIA come un potente inibitore dell'assorbimento del colesterolo.
In un modello di ratto, in cui il metabolita glucuronide di ezetimibe (SCH 60663) è stato somministrato per via intraduodenale, il metabolita era potente quanto il composto progenitore (SCH 58235) nell'inibire l'assorbimento del colesterolo, suggerendo che il metabolita glucuronide aveva un'attività simile a quella progenitrice droga.
In studi di 1 mese su cani trattati con ezetimibe (da 0,03 a 300 mg/kg/die), la concentrazione di colesterolo nella bile della cistifellea è aumentata di circa 2-4 volte. Tuttavia, una dose di 300 mg/kg/die somministrata ai cani per un anno non ha provocato la formazione di calcoli biliari o altri effetti avversi a livello epatobiliare. In uno studio di 14 giorni su topi trattati con ezetimibe (da 0,3 a 5 mg/kg/die) e alimentati con una dieta povera di grassi o ricca di colesterolo, la concentrazione di colesterolo nella bile della cistifellea non è stata modificata o è stata ridotta a livelli normali, rispettivamente.
È stata eseguita una serie di studi preclinici acuti per determinare la selettività di ZETIA nell'inibire l'assorbimento del colesterolo. Ezetimibe ha inibito l'assorbimento del colesterolo 14C senza alcun effetto sull'assorbimento di trigliceridi, acidi grassi, acidi biliari, progesterone, etinilestradiolo o vitamine liposolubili A e D.
In studi di tossicità da 4 a 12 settimane sui topi, ezetimibe non ha indotto enzimi che metabolizzano i farmaci del citocromo P450. Negli studi di tossicità è stata osservata un'interazione farmacocinetica di ezetimibe con le statine (genitori o loro metaboliti idrossiacidi attivi) in ratti, cani e conigli.
Studi clinici
Iperlipidemia primaria
ZETIA 10 mg riduce il C totale, il C-LDL, l'Apo B, il C non HDL e il TG e aumenta il C-HDL nei pazienti con iperlipidemia. La risposta da massima a quasi massima viene generalmente raggiunta entro 2 settimane e mantenuta durante la terapia cronica.
Monoterapia
In due studi multicentrici, in doppio cieco, controllati con placebo, della durata di 12 settimane su 1719 pazienti con iperlipidemia primaria, ZETIA ha ridotto significativamente il C totale, il C-LDL, l'Apo B, il C-non-HDL e il TG e ha aumentato l'HDL- C rispetto al placebo (vedere Tabella 6). La riduzione del C-LDL era coerente per età, sesso e C-LDL al basale.
TABELLA 6: Risposta a ZETIA 10 mg in pazienti con iperlipidemia primaria (variazione % media rispetto al basale non trattato†)
Combinazione con le statine
ZETIA 10mg aggiunto alla terapia con statine in corso
In uno studio multicentrico, in doppio cieco, controllato con placebo, di 8 settimane, 769 pazienti con iperlipidemia primaria, malattia coronarica nota o fattori di rischio cardiovascolare multipli che stavano già ricevendo statine in monoterapia, ma che non avevano raggiunto il loro target LDL NCEP ATP II -C obiettivo sono stati randomizzati a ricevere ZETIA 10 mg o placebo in aggiunta alla statina in corso.
ZETIA 10 mg, in aggiunta alla terapia in corso con statine, ha ridotto significativamente il C totale, il C-LDL, l'Apo B, il C-non HDL e il TG e ha aumentato il C-HDL rispetto a una statina somministrata da sola (vedere Tabella 7). Le riduzioni di LDL-C indotte da ZETIA 10 mg erano generalmente coerenti in tutte le statine.
TABELLA 7: Risposta all'aggiunta di ZETIA 10 mg alla terapia con statine in corso in pazienti con iperlipidemia (Variazione % media rispetto al basale trattato‡)
ZETIA avviato in concomitanza con una statina
In quattro studi multicentrici, in doppio cieco, controllati con placebo, della durata di 12 settimane, in 2382 pazienti iperlipidemici, ZETIA o il placebo sono stati somministrati da soli o con varie dosi di atorvastatina, simvastatina, pravastatina o lovastatina.
Quando tutti i pazienti che hanno ricevuto ZETIA con una statina sono stati confrontati con tutti quelli che hanno ricevuto la corrispondente statina da sola, ZETIA 10 mg ha ridotto significativamente il C totale, il C-LDL, l'Apo B, il C non HDL e il TG e, ad eccezione della pravastatina , aumento delle HDL-C rispetto alla statina somministrata da sola. Le riduzioni di LDL-C indotte da ZETIA 10 mg erano generalmente coerenti in tutte le statine. (Vedi nota a piè di pagina, Tabelle da 8 a 11.)
TABELLA 8: Risposta a ZETIA 10 mg e atorvastatina iniziata contemporaneamente in pazienti con iperlipidemia primaria (variazione % media rispetto al basale non trattato†)
TABELLA 9: Risposta a ZETIA 10 mg e simvastatina iniziata contemporaneamente in pazienti con iperlipidemia primaria (variazione % media rispetto al basale non trattato†)
TABELLA 10: Risposta a ZETIA e Pravastatina iniziate contemporaneamente in pazienti con iperlipidemia primaria (Variazione % media rispetto al basale non trattato†)
TABELLA 11: Risposta a ZETIA e Lovastatina iniziate contemporaneamente in pazienti con iperlipidemia primaria (Variazione % media rispetto al basale non trattato†)
Combinazione con Fenofibrato
In uno studio clinico multicentrico, in doppio cieco, controllato con placebo, condotto su pazienti con iperlipidemia mista, 625 pazienti sono stati trattati per un massimo di 12 settimane e 576 per un massimo di ulteriori 48 settimane. I pazienti sono stati randomizzati a ricevere placebo, ZETIA da solo, 160 mg di fenofibrato da solo o ZETIA 10 mg e 160 mg di fenofibrato nello studio di 12 settimane. Dopo aver completato lo studio di 12 settimane, i pazienti idonei sono stati assegnati a ZETIA somministrato in concomitanza con fenofibrato o fenofibrato in monoterapia per ulteriori 48 settimane.
ZETIA 10 mg somministrato in concomitanza con fenofibrato ha ridotto significativamente il C totale, il C-LDL, l'Apo B e il C non HDL rispetto al fenofibrato somministrato da solo. La diminuzione percentuale di TG e l'aumento percentuale di HDLC per ZETIA somministrato in concomitanza con fenofibrato erano paragonabili a quelli per fenofibrato somministrato da solo (vedere Tabella 12).
TABELLA 12: Risposta a ZETIA 10 mg e fenofibrato iniziato contemporaneamente in pazienti con iperlipidemia mista (variazione % media rispetto al basale non trattato† a 12 settimane†)
Le variazioni degli endpoint lipidici dopo ulteriori 48 settimane di trattamento con ZETIA somministrato in concomitanza con fenofibrato o con fenofibrato da solo erano coerenti con i dati a 12 settimane mostrati sopra.
Ipercolesterolemia Familiare Omozigote (HoFH)
È stato condotto uno studio per valutare l'efficacia di ZETIA nel trattamento dell'HoFH. Questo studio in doppio cieco, randomizzato, della durata di 12 settimane ha arruolato 50 pazienti con diagnosi clinica e/o genotipica di HoFH, con o senza aferesi LDL concomitante, già in trattamento con atorvastatina o simvastatina (40 mg). I pazienti sono stati randomizzati a uno dei tre gruppi di trattamento, atorvastatina o simvastatina (80 mg), ZETIA 10 mg somministrato con atorvastatina o simvastatina (40 mg) o ZETIA somministrato con atorvastatina o simvastatina (80 mg). A causa della ridotta biodisponibilità di ezetimibe nei pazienti che ricevono contemporaneamente colestiramina [vedere INTERAZIONI DI DROGA ], ezetimibe è stato somministrato almeno 4 ore prima o dopo la somministrazione delle resine. Il C-LDL medio al basale era di 341 mg/dL in quei pazienti randomizzati a ricevere atorvastatina 80 mg o simvastatina 80 mg da sola e 316 mg/dL nel gruppo randomizzato a ZETIA 10 mg più atorvastatina 40 o 80 mg o simvastatina 40 o 80 mg. ZETIA 10 mg, somministrato con atorvastatina o simvastatina (gruppi di statine da 40 e 80 mg, raggruppati), ha ridotto significativamente il C-LDL (21%) rispetto all'aumento della dose di simvastatina o atorvastatina in monoterapia da 40 a 80 mg (7%). In quelli trattati con ZETIA 10 mg più atorvastatina 80 mg o con ZETIA 10 mg più simvastatina 80 mg, il C-LDL è stato ridotto del 27%.
Sitosterolemia omozigote (fitosterolemia)
È stato condotto uno studio per valutare l'efficacia di ZETIA nel trattamento della sitosterolemia omozigote. In questo studio multicentrico, in doppio cieco, controllato con placebo, della durata di 8 settimane, 37 pazienti con omozigositosterolemia con livelli elevati di sitosterolo plasmatico (> 5 mg/dL) nel loro attuale regime terapeutico (dieta, resine leganti gli acidi biliari, statine, intervento chirurgico di bypass ileale e/o aferesi LDL), sono stati randomizzati a ricevere ZETIA (n=30) o placebo (n=7). A causa della ridotta biodisponibilità di ezetimibe nei pazienti che ricevono contemporaneamente colestiramina [vedere INTERAZIONI DI DROGA ], ezetimibe è stato somministrato almeno 2 ore prima o 4 ore dopo la somministrazione delle resine. Escludendo l'unico soggetto che ha ricevuto l'aferesi delle LDL, ZETIA ha ridotto significativamente il sitosterolo plasmatico e il campesterolo, rispettivamente del 21% e del 24% rispetto al basale. Al contrario, i pazienti che hanno ricevuto il placebo hanno avuto aumenti di sitosterolo e campesterolo rispettivamente del 4% e del 3% rispetto al basale. Per i pazienti trattati con ZETIA 10 mg, i livelli plasmatici medi di steroli vegetali sono stati ridotti progressivamente nel corso dello studio. Non sono stati stabiliti gli effetti della riduzione del sitosterolo plasmatico e del campesterolo sulla riduzione dei rischi di morbilità e mortalità cardiovascolare.
Le riduzioni di sitosterolo e campesterolo erano coerenti tra i pazienti che assumevano ZETIA 10 mg in concomitanza con sequestranti degli acidi biliari (n=8) e i pazienti non in terapia concomitante con sequestranti degli acidi biliari (n=21).
Limitazioni d'uso
L'effetto di ZETIA 10 mg sulla morbilità e mortalità cardiovascolare non è stato determinato.
INFORMAZIONI PER IL PAZIENTE
ZETIA® (ezetimibe) compresse
Informazioni per il paziente su ZETIA (zet´-ea)
Nome generico: ezetimibe (e-zet´-e-mib)
Legga attentamente queste informazioni prima di iniziare a prendere ZETIA® e ogni volta che assume più ZETIA. Potrebbero esserci nuove informazioni. Queste informazioni non sostituiscono il colloquio con il medico in merito alle proprie condizioni mediche o al trattamento. In caso di domande su ZETIA, si rivolga al medico. Solo il tuo medico può determinare se ZETIA è adatto a te.
Cos'è ZETIA?
ZETIA è un medicinale usato per abbassare i livelli di colesterolo totale e colesterolo LDL (cattivo) nel sangue. ZETIA è per i pazienti che non riescono a controllare i livelli di colesterolo con la dieta e l'esercizio fisico da soli. Può essere usato da solo o con altri medicinali per il trattamento del colesterolo alto. Dovresti seguire una dieta ipocolesterolemizzante durante l'assunzione di questo medicinale.
ZETIA lavora per ridurre la quantità di colesterolo che il tuo corpo assorbe. ZETIA 10mg non ti aiuta a perdere peso. ZETIA 10 mg non ha dimostrato di prevenire malattie cardiache o attacchi di cuore.
Per ulteriori informazioni sul colesterolo, vedere "Cosa dovrei sapere sul colesterolo alto?" sezione che segue.
Chi non dovrebbe assumere ZETIA 10 mg?
- Non prenda ZETIA 10 mg se è allergico all'ezetimibe, il principio attivo di ZETIA, o ai principi inattivi. Per un elenco degli ingredienti inattivi, vedere la sezione "Ingredienti inattivi" che segue.
- Se ha una malattia epatica attiva, non prenda ZETIA 10 mg durante l'assunzione di medicinali per abbassare il colesterolo chiamati statine.
- In caso di gravidanza o allattamento, non prenda ZETIA durante l'assunzione di statine.
- Se sei una donna in età fertile, dovresti usare un metodo efficace di controllo delle nascite per prevenire la gravidanza durante l'utilizzo di ZETIA in aggiunta alla terapia con statine.
ZETIA non è stato studiato nei bambini di età inferiore ai 10 anni.
Cosa devo dire al medico prima e durante l'assunzione di ZETIA 10 mg?
Informi il medico di eventuali medicinali soggetti a prescrizione e senza prescrizione medica che stai assumendo o prevedi di assumere, compresi i rimedi naturali o erboristici.
Informa il tuo medico di tutte le tue condizioni mediche comprese le allergie.
Informi il medico se:
- mai avuto problemi al fegato. ZETIA 10 mg potrebbe non essere adatto a te.
- sono incinta o stanno pianificando una gravidanza. Il medico discuterà con te se ZETIA 10 mg è adatto a te.
- stanno allattando. Non sappiamo se ZETIA 10mg possa passare al tuo bambino attraverso il tuo latte. Il medico discuterà con te se ZETIA 10 mg è adatto a te.
- provare dolore muscolare, dolorabilità o debolezza inspiegabili.
Come devo prendere ZETIA 10 mg?
- Prendi ZETIA una volta al giorno, con o senza cibo. Potrebbe essere più facile ricordarsi di prendere la dose se lo fai alla stessa ora ogni giorno, ad esempio a colazione, a cena o prima di coricarsi. Se prende anche un altro medicinale per ridurre il colesterolo, chieda al medico se può prenderli contemporaneamente.
- Se dimentica di prendere ZETIA, lo prenda non appena se ne ricorda. Tuttavia, non prenda più di una dose di ZETIA al giorno.
- Continuare a seguire una dieta ipocolesterolemizzante durante l'assunzione di ZETIA. Chiedi al tuo medico se hai bisogno di informazioni sulla dieta.
- Continui a prendere ZETIA 10 mg a meno che il medico non le dica di interrompere. È importante continuare a prendere ZETIA 10 mg anche se non si sente male.
- Consulta regolarmente il tuo medico per controllare il livello di colesterolo e per verificare la presenza di effetti collaterali. Il medico può eseguire esami del sangue per controllare il fegato prima di iniziare a prendere ZETIA con una statina e durante il trattamento.
Quali sono i possibili effetti collaterali di ZETIA?
Negli studi clinici i pazienti hanno riportato pochi effetti collaterali durante l'assunzione di ZETIA. Questi includevano diarrea, dolori articolari e sensazione di stanchezza.
I pazienti hanno avuto gravi problemi muscolari durante l'assunzione di ZETIA 10 mg, di solito quando ZETIA 10 mg è stato aggiunto a una statina. Se avverte dolore muscolare, dolorabilità o debolezza inspiegabili durante l'assunzione di ZETIA, contatti immediatamente il medico. È necessario farlo tempestivamente, perché in rare occasioni questi problemi muscolari possono essere seri, con la rottura dei muscoli con conseguente danno renale.
Inoltre, sono stati segnalati i seguenti effetti indesiderati nell'uso generale: reazioni allergiche (che possono richiedere un trattamento immediato) incluso gonfiore del viso, delle labbra, della lingua e/o della gola che possono causare difficoltà a respirare o deglutire, eruzioni cutanee e orticaria ; eruzione cutanea rossa in rilievo, a volte con lesioni a forma di bersaglio; dolori articolari; dolori muscolari; alterazioni in alcuni esami del sangue di laboratorio; problemi al fegato; mal di stomaco; infiammazione del pancreas; nausea; vertigini; sensazione di formicolio; depressione; male alla testa; calcoli biliari; infiammazione della cistifellea.
Informi il medico se si verificano questi o altri problemi medici durante il trattamento con ZETIA. Per un elenco completo degli effetti collaterali, chiedi al tuo medico o al farmacista.
Cosa dovrei sapere sul colesterolo alto?
Il colesterolo è un tipo di grasso presente nel sangue. Il tuo colesterolo totale è composto da colesterolo LDL e HDL.
Il colesterolo LDL è chiamato colesterolo "cattivo" perché può accumularsi nella parete delle arterie e formare placca. Nel tempo, l'accumulo di placca può causare un restringimento delle arterie. Questo restringimento può rallentare o bloccare il flusso sanguigno al cuore, al cervello e ad altri organi. Il colesterolo LDL alto è una delle principali cause di malattie cardiache e una delle cause di ictus.
Il colesterolo HDL è chiamato colesterolo “buono” perché impedisce al colesterolo cattivo di accumularsi nelle arterie.
I trigliceridi sono anche grassi presenti nel sangue.
Informazioni generali su ZETIA
Talvolta vengono prescritti medicinali per condizioni che non sono menzionate nei fogli informativi per i pazienti. Non utilizzare ZETIA 10 mg per una condizione per la quale non è stato prescritto. Non somministrare ZETIA ad altre persone, anche se hanno la tua stessa condizione. Potrebbe danneggiarli.
Questo riassume le informazioni più importanti su ZETIA. Se desideri maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo farmacista o medico informazioni su ZETIA 10mg che è scritto per gli operatori sanitari.
Ingredienti inattivi :
Croscarmellosa sodica, lattosio monoidrato, magnesio stearato, cellulosa microcristallina, povidone e sodio lauril solfato.
