Proscar 5mg Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Proscar 5mg e come si usa?
Proscar è un medicinale su prescrizione usato per trattare i sintomi dell'iperplasia prostatica benigna e dell'alopecia androgena. Questo medicinale è destinato esclusivamente agli uomini. Proscar 5mg può essere usato da solo o con altri farmaci.
Proscar appartiene a una classe di farmaci chiamati inibitori della 5-alfa-reduttasi.
Non è noto se Proscar 5mg sia sicuro ed efficace nei bambini.
Quali sono i possibili effetti collaterali di Proscar 5mg?
Proscar può causare gravi effetti collaterali tra cui:
- nausea grave o continua,
- respirazione difficoltosa,
- gonfiore del viso, delle labbra, della lingua o della gola,
- noduli al seno,
- dolore o tenerezza al seno,
- secrezione del capezzolo e
- altri cambiamenti del seno
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Proscar includono:
- perdita di interesse per il sesso,
- impotenza,
- problemi ad avere un orgasmo, e
- eiaculazione anormale
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Proscar. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
PROSCAR (finasteride), un composto sintetico 4-azasteroide, è un inibitore specifico della 5α-reduttasi steroidea di tipo II, un enzima intracellulare che converte il testosterone androgeno in 5α-diidrotestosterone (DHT).
La finasteride è 4-azaandrost-1-ene-17-carbossammide, N-(1,1-dimetiletil)-3-osso-,(5α,17ß)-. La formula empirica della finasteride è C23H36N2O2 e il suo peso molecolare è 372,55. La sua formula strutturale è:
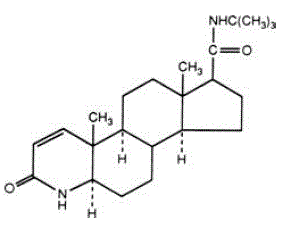
La finasteride è una polvere cristallina bianca con un punto di fusione vicino a 250°C. È facilmente solubile in cloroformio e in solventi a basso contenuto di alcol, ma è praticamente insolubile in acqua.
Le compresse di PROSCAR (finasteride) per somministrazione orale sono compresse rivestite con film che contengono 5 mg di finasteride e i seguenti eccipienti: lattosio idrato, cellulosa microcristallina, amido pregelatinizzato, sodio amido glicolato, idrossipropilcellulosa LF, idrossipropilmetilcellulosa, biossido di titanio, magnesio stearato , talco, sodio docusato, lacca di alluminio FD&C Blue 2 e ossido di ferro giallo.
INDICAZIONI
Monoterapia
PROSCAR® è indicato per il trattamento dell'iperplasia prostatica benigna (BPH) sintomatica negli uomini con ingrossamento della prostata a:
- Migliora i sintomi
- Ridurre il rischio di ritenzione urinaria acuta
- Ridurre il rischio della necessità di un intervento chirurgico, compresa la resezione transuretrale della prostata (TURP) e la prostatectomia.
Combinazione con Alpha-Blocker
PROSCAR 5 mg somministrato in combinazione con l'alfa-bloccante doxazosina è indicato per ridurre il rischio di progressione sintomatica dell'IPB (un aumento confermato di ≥4 punti nel punteggio dei sintomi dell'American Urological Association (AUA)).
Limitazioni d'uso
PROSCAR non è approvato per la prevenzione del cancro alla prostata.
DOSAGGIO E SOMMINISTRAZIONE
PROSCAR può essere somministrato con o senza pasti.
Monoterapia
La dose raccomandata di PROSCAR è una compressa (5 mg) assunta una volta al giorno [vedi Studi clinici ].
Combinazione con Alpha-Blocker
La dose raccomandata di PROSCAR è una compressa (5 mg) assunta una volta al giorno in combinazione con l'alfa-bloccante doxazosina [vedi Studi clinici ].
COME FORNITO
Forme di dosaggio e punti di forza
Compresse rivestite con film blu a forma di mela modificata da 5 mg, con il codice MSD 72 su un lato e PROSCAR 5 mg sull'altro.
Stoccaggio e manipolazione
N. 3094 - PROSCAR compresse 5 mg sono compresse rivestite con film blu, modificate a forma di mela, con il codice MSD 72 su un lato e PROSCAR sull'altro. Sono forniti come segue:
NDC 0006-0072-31 unità d'uso bottiglie da 30 NDC 0006-0072-58 unità d'uso bottiglie da 100.
Stoccaggio e manipolazione
Conservare a temperatura ambiente inferiore a 30°C (86°F). Proteggere dalla luce e tenere il contenitore ben chiuso.
Le donne non devono maneggiare compresse di PROSCAR 5 mg frantumate o rotte durante la gravidanza o potrebbero essere potenzialmente in gravidanza a causa della possibilità di assorbimento della finasteride e del conseguente potenziale rischio per un feto maschio [vedi AVVERTENZE E PRECAUZIONI  e Utilizzare in popolazioni specifiche ].
Distribuito da: Merck Sharp & Dohme Corp., una sussidiaria di MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revisionato: giugno 2021
EFFETTI COLLATERALI
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica clinica.
Studio di 4 anni controllato con placebo (PLESS)
Nello studio PLESS, 1524 pazienti trattati con PROSCAR e 1516 pazienti trattati con placebo sono stati valutati per la sicurezza in un periodo di 4 anni. Le reazioni avverse riportate più frequentemente erano correlate alla funzione sessuale. Il 3,7% (57 pazienti) trattato con PROSCAR 5 mg e il 2,1% (32 pazienti) trattato con placebo ha interrotto la terapia a causa di reazioni avverse correlate alla funzione sessuale, che sono le reazioni avverse riportate più frequentemente.
La tabella 1 presenta le uniche reazioni avverse cliniche considerate possibilmente, probabilmente o definitivamente correlate al farmaco dallo sperimentatore, per le quali l'incidenza su PROSCAR 5 mg è stata ≥1% e maggiore rispetto al placebo nei 4 anni dello studio. Negli anni 2-4 dello studio, non vi era alcuna differenza significativa tra i gruppi di trattamento nell'incidenza di impotenza, diminuzione della libido e disturbo dell'eiaculazione.
Studi di fase III ed estensioni aperte di 5 anni
Il profilo dell'esperienza avversa negli studi di Fase III di 1 anno, controllati con placebo, nelle estensioni in aperto di 5 anni e nel PLESS erano simili.
Studio sulla terapia medica dei sintomi prostatici (MTOPS).
Nello studio MTOPS, 3047 uomini con IPB sintomatico sono stati randomizzati a ricevere PROSCAR 5 mg/die (n=768), doxazosina 4 o 8 mg/die (n=756), la combinazione di PROSCAR 5 mg/die e doxazosina 4 o 8 mg/die (n=786) o placebo (n=737) da 4 a 6 anni. [Vedere un Studi clinici .]
tassi di incidenza delle esperienze avverse correlate al farmaco riportate da ≥2% dei pazienti in qualsiasi gruppo di trattamento nello studio MTOPS sono elencati nella Tabella 2.
Gli effetti avversi individuali che si sono verificati più frequentemente nel gruppo di associazione rispetto a entrambi i farmaci da soli sono stati: astenia, ipotensione posturale, edema periferico, vertigini, diminuzione della libido, rinite, eiaculazione anormale, impotenza e funzione sessuale anormale (vedere Tabella 2). Di questi, l'incidenza di eiaculazione anormale nei pazienti che ricevevano la terapia di associazione era paragonabile alla somma delle incidenze di questa esperienza avversa riportata per le due monoterapie.
La terapia di associazione con finasteride e doxazosina è stata associata a nessuna nuova esperienza clinica avversa.
Quattro pazienti in MTOPS hanno riportato l'esperienza avversa di cancro al seno. Tre di questi pazienti assumevano solo finasteride e uno era in terapia combinata. [Vedere un Dati a lungo termine .]
Lo studio MTOPS non è stato specificamente progettato per effettuare confronti statistici tra i gruppi per le esperienze avverse riportate. Inoltre, il confronto diretto dei dati sulla sicurezza tra lo studio MTOPS e gli studi precedenti sui singoli agenti potrebbe non essere appropriato sulla base delle differenze nella popolazione di pazienti, nel dosaggio o nel regime posologico e in altri elementi procedurali e di progettazione dello studio.
Dati a lungo termine
Cancro alla prostata di alto grado
Lo studio PCPT era uno studio randomizzato, in doppio cieco, controllato con placebo della durata di 7 anni che ha arruolato 18.882 uomini di età ≥55 anni con un normale esame rettale digitale e un PSA ≤3,0 ng/mL. Gli uomini hanno ricevuto quotidianamente PROSCAR (finasteride 5 mg) o placebo. I pazienti sono stati valutati annualmente con PSA ed esami rettali digitali. Sono state eseguite biopsie per PSA elevato, un esame rettale digitale anormale o la fine dello studio. L'incidenza del cancro alla prostata con punteggio di Gleason 8-10 era maggiore negli uomini trattati con finasteride (1,8%) rispetto a quelli trattati con placebo (1,1%) [vedi INDICAZIONI  e AVVERTENZE E PRECAUZIONI ]. In uno studio clinico di 4 anni controllato con placebo con un altro inibitore della 5α-reduttasi (dutasteride, AVODART), sono stati osservati risultati simili per il cancro alla prostata con punteggio di Gleason 8-10 (1% dutasteride vs 0,5% placebo).
Nessun beneficio clinico è stato dimostrato nei pazienti con cancro alla prostata trattati con PROSCAR.
Cancro al seno
Durante lo studio MTOPS controllato con placebo e comparatore della durata di 4-6 anni, che ha arruolato 3047 uomini, si sono verificati 4 casi di cancro al seno negli uomini trattati con finasteride ma nessun caso negli uomini non trattati con finasteride. Durante lo studio PLESS di 4 anni, controllato con placebo, che ha arruolato 3040 uomini, si sono verificati 2 casi di cancro al seno negli uomini trattati con placebo, ma nessun caso negli uomini trattati con finasteride. Durante il 7 anni controllato con placebo per la prevenzione del cancro alla prostata Trial (PCPT) che ha arruolato 18.882 uomini, si è verificato 1 caso di cancro al seno negli uomini trattati con finasteride e 1 caso di cancro al seno negli uomini trattati con placebo. La relazione tra l'uso a lungo termine della finasteride e la neoplasia mammaria maschile è attualmente sconosciuta.
Funzione sessuale
Non ci sono prove di un aumento delle esperienze avverse sessuali con una maggiore durata del trattamento con PROSCAR. Le nuove segnalazioni di esperienze avverse sessuali correlate al farmaco sono diminuite con la durata della terapia.
Esperienza di post marketing
seguenti eventi avversi aggiuntivi sono stati segnalati nell'esperienza post-marketing con PROSCAR. Poiché questi eventi sono segnalati volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con l'esposizione al farmaco:
- reazioni di ipersensibilità, come prurito, orticaria e angioedema (incluso gonfiore delle labbra, della lingua, della gola e del viso)
- dolore ai testicoli
- ematospermia
- disfunzione sessuale continuata dopo l'interruzione del trattamento, inclusa disfunzione erettile, diminuzione della libido e disturbi dell'eiaculazione (ad es. volume dell'eiaculato ridotto). Questi eventi sono stati riportati raramente negli uomini che assumevano PROSCAR per il trattamento dell'IPB. La maggior parte degli uomini erano più anziani e stavano assumendo farmaci concomitanti e/o avevano condizioni di co-morbilità. Il ruolo indipendente di PROSCAR 5mg in questi eventi è sconosciuto.
- infertilità maschile e/o scarsa qualità seminale sono stati riportati raramente negli uomini che assumevano PROSCAR 5 mg per il trattamento dell'IPB. Dopo l'interruzione della finasteride è stata segnalata la normalizzazione o il miglioramento della scarsa qualità seminale. Il ruolo indipendente di PROSCAR in questi eventi è sconosciuto.
- depressione
- cancro al seno maschile.
Il seguente evento avverso aggiuntivo correlato a disfunzione sessuale che è continuata dopo l'interruzione del trattamento è stato riportato nell'esperienza post-marketing con finasteride a dosi più basse utilizzate per il trattamento della calvizie maschile. Poiché l'evento viene segnalato volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco:
- disturbi dell'orgasmo
INTERAZIONI DI DROGA
Sistema enzimatico di metabolizzazione del farmaco legato al citocromo P450
Non sono state identificate interazioni farmacologiche di importanza clinica. La finasteride non sembra influenzare il sistema enzimatico di metabolizzazione del farmaco legato al citocromo P450. I composti che sono stati testati nell'uomo hanno incluso antipirina, digossina, propranololo, teofillina e warfarin e non sono state trovate interazioni clinicamente significative.
Altre terapie concomitanti
Sebbene non siano stati condotti studi di interazione specifici, PROSCAR 5 mg è stato utilizzato in concomitanza in studi clinici con paracetamolo, acido acetilsalicilico, α-bloccanti, inibitori dell'enzima di conversione dell'angiotensina (ACE), analgesici, anticonvulsivanti, agenti beta-bloccanti adrenergici, diuretici, calcio bloccanti dei canali, nitrati cardiaci, inibitori della HMG-CoA reduttasi, farmaci antinfiammatori non steroidei (FANS), benzodiazepine, antagonisti H2 e anti-infettivi chinolonici senza evidenza di interazioni avverse clinicamente significative.
AVVERTENZE
Incluso come parte del "PRECAUZIONI" Sezione
PRECAUZIONI
Effetti sull'antigene specifico della prostata (PSA) e sull'uso del PSA nella rilevazione del cancro alla prostata
Negli studi clinici, PROSCAR ha ridotto la concentrazione sierica di PSA di circa il 50% entro sei mesi dal trattamento. Questa diminuzione è prevedibile sull'intero intervallo dei valori di PSA nei pazienti con IPB sintomatico, sebbene possa variare negli individui.
Per l'interpretazione dei PSA seriali negli uomini che assumono PROSCAR, deve essere stabilito un nuovo riferimento di base del PSA almeno sei mesi dopo l'inizio del trattamento e successivamente monitorato periodicamente il PSA. Qualsiasi aumento confermato dal valore di PSA più basso durante l'assunzione di PROSCAR 5 mg può segnalare la presenza di cancro alla prostata e deve essere valutato, anche se i livelli di PSA sono ancora entro l'intervallo normale per gli uomini che non assumono un inibitore della 5α reduttasi. La mancata osservanza della terapia PROSCAR può anche influenzare i risultati del test PSA. Per interpretare un valore di PSA isolato nei pazienti trattati con PROSCAR 5 mg per sei mesi o più, i valori di PSA devono essere raddoppiati per il confronto con gli intervalli normali negli uomini non trattati. Questi aggiustamenti preservano l'utilità del PSA per rilevare il cancro alla prostata negli uomini trattati con PROSCAR.
PROSCAR può anche causare diminuzioni del PSA sierico in presenza di cancro alla prostata.
Il rapporto tra PSA libero e totale (PSA libero percentuale) rimane costante anche sotto l'influenza di PROSCAR. Se i medici scelgono di utilizzare la percentuale di PSA libero come ausilio per l'individuazione del cancro alla prostata negli uomini sottoposti a terapia con finasteride, non sembra necessario alcun aggiustamento al suo valore.
Aumento del rischio di cancro alla prostata di alto grado
Gli uomini di età pari o superiore a 55 anni con un normale esame rettale digitale e PSA ≤3,0 ng/mL al basale che assumevano finasteride 5 mg/die nello studio di 7 anni per la prevenzione del cancro alla prostata (PCPT) avevano un rischio aumentato di cancro alla prostata con punteggio di Gleason 8-10 (finasteride 1,8% vs placebo 1,1%). [Vedere un INDICAZIONI  e REAZIONI AVVERSE .] Risultati simili sono stati osservati in uno studio clinico di 4 anni controllato con placebo con un altro inibitore della 5α-reduttasi (dutasteride, AVODART) (1% dutasteride vs 0,5% placebo). Gli inibitori della 5αreduttasi possono aumentare il rischio di sviluppo di cancro alla prostata di alto grado. Non è stato stabilito se l'effetto degli inibitori della 5α-reduttasi sulla riduzione del volume della prostata, o fattori correlati allo studio, abbia influenzato i risultati di questi studi.
Esposizione delle femmine
Rischio per il feto maschio
PROSCAR è controindicato nelle donne in gravidanza e nelle donne che potrebbero essere potenzialmente in gravidanza e non è indicato per l'uso nelle donne. Sulla base di studi sugli animali e del meccanismo d'azione, PROSCAR 5 mg può causare uno sviluppo anormale dei genitali esterni in un feto maschio se somministrato a una femmina incinta. Le donne in gravidanza o potenzialmente in gravidanza non devono maneggiare le compresse di PROSCAR 5 mg frantumate o rotte. Le compresse di PROSCAR 5 mg sono rivestite e impediscono il contatto con il principio attivo durante la normale manipolazione, a condizione che le compresse non siano state rotte o frantumate. Se una donna incinta entra in contatto con compresse di PROSCAR 5 mg frantumate o rotte, l'area di contatto deve essere lavata immediatamente con acqua e sapone. [Vedere un CONTROINDICAZIONI ,UN Utilizzare in popolazioni specifiche ,UN FARMACOLOGIA CLINICA , e COME FORNITO .]
Pazienti pediatrici e femmine
PROSCAR non è indicato per l'uso nei pazienti pediatrici [vedi Utilizzare in popolazioni specifiche  e FARMACOLOGIA CLINICA ] o femmine [vedi anche AVVERTENZE E PRECAUZIONI ,UN Utilizzare in popolazioni specifiche ,UN FARMACOLOGIA CLINICA , e COME FORNITO ].
Effetto sulle caratteristiche dello sperma
Il trattamento con PROSCAR per 24 settimane per valutare i parametri dello sperma in volontari maschi sani non ha rivelato effetti clinicamente significativi sulla concentrazione, mobilità, morfologia o pH degli spermatozoi. È stata osservata una diminuzione mediana di 0,6 ml (22,1%) del volume dell'eiaculato con una concomitante riduzione dello sperma totale per eiaculato. Questi parametri sono rimasti nell'intervallo normale ed erano reversibili con l'interruzione della terapia con un tempo medio per tornare al valore basale di 84 settimane.
Considerazione di altre condizioni urologiche
Prima di iniziare il trattamento con PROSCAR 5 mg, è necessario prendere in considerazione altre condizioni urologiche che possono causare sintomi simili. Inoltre, il cancro alla prostata e l'IPB possono coesistere.
I pazienti con volume urinario residuo elevato e/o flusso urinario gravemente ridotto devono essere attentamente monitorati per l'uropatia ostruttiva. Questi pazienti potrebbero non essere candidati alla terapia con finasteride.
Informazioni di consulenza per il paziente
Consigliare al paziente di leggere l'etichettatura del paziente approvata dalla FDA ( INFORMAZIONI PER IL PAZIENTE ).
Aumento del rischio di cancro alla prostata di alto grado
pazienti devono essere informati che c'è stato un aumento del cancro alla prostata di alto grado negli uomini trattati con inibitori della 5α-reduttasi indicati per il trattamento dell'IPB, incluso PROSCAR 5 mg, rispetto a quelli trattati con placebo negli studi sull'uso di questi farmaci per prevenire la prostata cancro [vedi INDICAZIONI ,UN AVVERTENZE E PRECAUZIONI , e REAZIONI AVVERSE ].
Esposizione delle femmine - Rischio per il feto maschio
I medici devono informare i pazienti che le donne in gravidanza o potenzialmente in gravidanza non devono maneggiare le compresse di PROSCAR frantumate o rotte a causa della possibilità di assorbimento della finasteride e del conseguente potenziale rischio per il feto maschio. Le compresse di PROSCAR sono rivestite e impediscono il contatto con il principio attivo durante la normale manipolazione, a condizione che le compresse non siano state rotte o frantumate. Se una donna incinta o potenzialmente incinta entra in contatto con compresse di PROSCAR frantumate o rotte, l'area di contatto deve essere lavata immediatamente con acqua e sapone [vedi CONTROINDICAZIONI ,UN AVVERTENZE E PRECAUZIONI ,UN Utilizzare in popolazioni specifiche  e COME FORNITO ].
istruzioni addizionali
medici devono informare i pazienti che il volume dell'eiaculato può diminuire in alcuni pazienti durante il trattamento con PROSCAR. Questa diminuzione non sembra interferire con la normale funzione sessuale. Tuttavia, nei pazienti trattati con PROSCAR possono verificarsi impotenza e diminuzione della libido [vedi REAZIONI AVVERSE ].
I medici dovrebbero istruire i loro pazienti a segnalare tempestivamente eventuali cambiamenti nel loro seno come noduli, dolore o secrezione dai capezzoli. Sono stati segnalati cambiamenti del seno tra cui ingrossamento del seno, dolorabilità e neoplasie [vedi REAZIONI AVVERSE ].
I medici devono istruire i loro pazienti a leggere il foglietto illustrativo del paziente prima di iniziare la terapia con PROSCAR 5 mg e a rileggerlo ogni volta che la prescrizione viene rinnovata in modo che siano a conoscenza delle informazioni aggiornate per i pazienti in merito a PROSCAR.
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Cancerogenesi
Nessuna evidenza di un effetto tumorigeno è stata osservata in uno studio di 24 mesi in ratti Sprague-Dawley che hanno ricevuto dosi di finasteride fino a 160 mg/kg/die nei maschi e 320 mg/kg/die nelle femmine. Queste dosi hanno prodotto una rispettiva esposizione sistemica nei ratti di 111 e 274 volte quella osservata nell'uomo che riceveva la dose umana raccomandata di 5 mg/die. Tutti i calcoli dell'esposizione si basavano sull'AUC calcolata (0-24 ore) per gli animali e sull'AUC media (0-24 ore) per l'uomo (0,4 μg•ora/mL).
In uno studio di cancerogenicità di 19 mesi su topi CD-1, è stato osservato un aumento statisticamente significativo (p≤0,05) dell'incidenza di adenomi a cellule di Leydig testicolari a 228 volte l'esposizione umana (250 mg/kg/giorno). Nei topi a 23 volte l'esposizione umana, stimata (25 mg/kg/giorno) e nei ratti a 39 volte l'esposizione umana (40 mg/kg/giorno) è stato osservato un aumento dell'incidenza dell'iperplasia delle cellule di Leydig. Una correlazione positiva tra i cambiamenti proliferativi nelle cellule di Leydig e un aumento dei livelli sierici di LH (da 2 a 3 volte sopra il controllo) è stata dimostrata in entrambe le specie di roditori trattate con dosi elevate di finasteride. Non sono state osservate alterazioni delle cellule di Leydig correlate al farmaco né nei ratti né nei cani trattati con finasteride per 1 anno a 30 e 350 volte (20 mg/kg/die e 45 mg/kg/die, rispettivamente) o nei topi trattati per 19 mesi a 2,3 volte l'esposizione umana stimata (2,5 mg/kg/giorno).
Mutagenesi
Nessuna evidenza di mutagenicità è stata osservata in un saggio di mutagenesi batterica in vitro, un saggio di mutagenesi delle cellule di mammifero o in un saggio di eluizione alcalina in vitro. In un test di aberrazione cromosomica in vitro, utilizzando cellule ovariche di criceto cinese, si è verificato un leggero aumento delle aberrazioni cromosomiche. Queste concentrazioni corrispondono a 4000-5000 volte i livelli plasmatici di picco nell'uomo con una dose totale di 5 mg. In un test di aberrazione cromosomica in vivo nei topi, non è stato osservato alcun aumento correlato al trattamento dell'aberrazione cromosomica con finasteride alla dose massima tollerata di 250 mg/kg/giorno (228 volte l'esposizione umana) come determinato negli studi di cancerogenicità.
Compromissione della fertilità
In conigli maschi sessualmente maturi trattati con finasteride a 543 volte l'esposizione umana (80 mg/kg/giorno) per un massimo di 12 settimane, non è stato osservato alcun effetto sulla fertilità, sulla conta spermatica o sul volume dell'eiaculato. Nei ratti maschi sessualmente maturi trattati con un'esposizione 61 volte superiore a quella umana (80 mg/kg/giorno), non si sono verificati effetti significativi sulla fertilità dopo 6 o 12 settimane di trattamento; tuttavia, quando il trattamento è proseguito fino a 24 o 30 settimane, si è verificata un'apparente diminuzione della fertilità, della fecondità e una significativa diminuzione associata del peso delle vescicole seminali e della prostata. Tutti questi effetti erano reversibili entro 6 settimane dall'interruzione del trattamento. Nessun effetto correlato al farmaco sui testicoli o sulle prestazioni di accoppiamento è stato osservato nei ratti o nei conigli. Questa diminuzione della fertilità nei ratti trattati con finasteride è secondaria al suo effetto sugli organi sessuali accessori (prostata e vescicole seminali) con conseguente mancata formazione di un tappo seminale. Il tappo seminale è essenziale per la normale fertilità nei ratti e non è rilevante nell'uomo.
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
PROSCAR è controindicato nelle donne in gravidanza e non indicato per l'uso nelle donne. Sulla base di studi sugli animali e del meccanismo d'azione, PROSCAR 5 mg può causare uno sviluppo anormale dei genitali esterni in un feto maschio se somministrato a una femmina incinta [vedi AVVERTENZE E PRECAUZIONI  e FARMACOLOGIA CLINICA ].
In uno studio sullo sviluppo embrio-fetale nei ratti, si è verificato un aumento dose-dipendente dell'ipospadia che si è verificato nel 3,6-100% dei discendenti maschi di ratte gravide a cui è stata somministrata finasteride orale durante il periodo dell'organogenesi maggiore a dosi da circa 0,1 a 86 volte la massima dose umana raccomandata (MRHD) di 5 mg/die (basata sull'AUC a dosi animali comprese tra 0,1 e 100 mg/kg/die).
Sono stati osservati anche diminuzione del peso della vescicola prostatica e seminale, separazione prepuziale ritardata e sviluppo transitorio del capezzolo nella prole maschile a dosi materne orali circa 0,03 volte la MRHD (basata sull'AUC alla dose animale di 0,03 mg/kg/giorno), insieme a una ridotta distanza anogenitale nella prole maschile a dosi materne orali circa 0,003 volte la MRHD (basata sull'AUC alla dose animale di 0,003 mg/kg/giorno).
PROSCAR è un inibitore della 5α-reduttasi di tipo II che impedisce la conversione del testosterone in 5α-diidrotestosterone (DHT), un ormone necessario per il normale sviluppo dei genitali maschili. Se questo farmaco viene utilizzato durante la gravidanza o se la paziente rimane incinta durante l'assunzione di questo farmaco, la paziente deve essere informata del potenziale pericolo per il feto maschio.
Lo sviluppo anormale dei genitali maschili è una conseguenza prevista quando la conversione del testosterone in 5α-diidrotestosterone (DHT) è inibita dagli inibitori della 5α-reduttasi. Questi risultati sono simili a quelli riportati nei neonati maschi con deficit genetico della 5α-reduttasi. Le femmine potrebbero essere esposte alla finasteride attraverso il contatto con compresse di PROSCAR frantumate o rotte o lo sperma di un partner maschio che assume PROSCAR. Per quanto riguarda l'esposizione alla finasteride attraverso la pelle, le compresse di PROSCAR 5 mg sono rivestite e impediscono il contatto della pelle con la finasteride durante la normale manipolazione se le compresse non sono state frantumate o rotte. Le donne in gravidanza o potenzialmente in gravidanza non devono maneggiare compresse di PROSCAR 5 mg frantumate o rotte a causa della possibile esposizione di un feto maschio. Per quanto riguarda la potenziale esposizione alla finasteride attraverso lo sperma, sono stati condotti tre studi che hanno misurato le concentrazioni di finasteride nello sperma negli uomini che ricevevano PROSCAR 5 mg/die. In questi studi si stima che la quantità più alta di finasteride nello sperma fosse da 50 a 100 volte inferiore alla dose di finasteride (5 μg) che non ha avuto alcun effetto sui livelli di DHT circolanti negli uomini [vedi Dati  e FARMACOLOGIA CLINICA ].
Dati
Dati umani
In 2 studi su soggetti sani (n=69) trattati con PROSCAR 5 mg/die per 6-24 settimane, le concentrazioni di finasteride nel liquido seminale variavano da non rilevabili ( FARMACOLOGIA CLINICA ].

Dati sugli animali
In uno studio sullo sviluppo embrio-fetale, ratte gravide hanno ricevuto finasteride durante il periodo di maggiore organogenesi (da 6 a 17 giorni di gestazione). A dosi materne di finasteride orale da circa 0,1 a 86 volte la dose massima raccomandata nell'uomo (MRHD) di 5 mg/die (basata sull'AUC a dosi animali comprese tra 0,1 e 100 mg/kg/die) si è verificato un aumento dose-dipendente dell'ipospadia che si è verificato nel 3,6-100% della prole maschile. I multipli di esposizione sono stati stimati utilizzando i dati di ratti non gravidi. I giorni da 16 a 17 di gestazione sono un periodo critico nei ratti fetali maschi per la differenziazione dei genitali esterni. A dosi materne orali di circa 0,03 volte la MRHD (basata sull'AUC alla dose animale di 0,03 mg/kg/giorno), la prole maschile aveva un peso vescicolare prostatico e seminale ridotto, separazione prepuziale ritardata e sviluppo transitorio del capezzolo. Una riduzione della distanza anogenitale si è verificata nella progenie maschile di ratti gravidi che hanno ricevuto circa 0,003 volte la MRHD (basata sull'AUC alla dose animale di 0,003 mg/kg/giorno). Non sono state osservate anomalie nella prole femminile a qualsiasi dose materna di finasteride.
Non sono state osservate anomalie dello sviluppo nella prole di femmine non trattate accoppiate con ratti maschi trattati con finasteride che hanno ricevuto circa 61 volte la MRHD (basata sull'AUC alla dose animale di 80 mg/kg/giorno). È stata osservata una lieve diminuzione della fertilità nella prole maschile dopo la somministrazione di circa 3 volte la MRHD (basata sull'AUC alla dose animale di 3 mg/kg/giorno) a ratti femmine durante la tarda gestazione e l'allattamento. Non sono stati osservati effetti sulla fertilità nella prole femminile in queste condizioni.
Non sono state osservate evidenze di malformazioni genitali esterne maschili o altre anomalie nei feti di coniglio esposti alla finasteride durante il periodo di maggiore organogenesi (giorni di gestazione 6-18) a dosi orali materne fino a 100 mg/kg/die (i livelli di esposizione alla finasteride non erano misurato nei conigli). Tuttavia, questo studio potrebbe non aver incluso il periodo critico per gli effetti della finasteride sullo sviluppo dei genitali esterni maschili nel coniglio.
Gli effetti fetali dell'esposizione materna alla finasteride durante il periodo di sviluppo embrionale e fetale sono stati valutati nella scimmia rhesus (giorni di gestazione 20-100), in una specie e periodo di sviluppo più predittivi di effetti specifici nell'uomo rispetto agli studi su ratti e conigli. La somministrazione endovenosa di finasteride a scimmie gravide a dosi fino a 800 ng/die (concentrazione ematica massima stimata di 1,86 ng/mL o circa 143 volte l'esposizione stimata più alta delle femmine gravide alla finasteride da sperma di uomini che assumevano 5 mg/die) è risultata in assenza di anomalie nei feti maschi. A conferma della rilevanza del modello rhesus per lo sviluppo fetale umano, la somministrazione orale di una dose di finasteride (2 mg/kg/die o circa 18.000 volte i livelli ematici di finasteride più alti stimati dallo sperma di uomini che assumono 5 mg/die) a le scimmie gravide hanno provocato anomalie genitali esterne nei feti maschi. Non sono state osservate altre anomalie nei feti maschi e nessuna anomalia correlata alla finasteride è stata osservata nei feti femmine a qualsiasi dose.
Allattamento
Riepilogo dei rischi
PROSCAR non è indicato per l'uso nelle donne.
Femmine E Maschi Di Potenziale Riproduttivo
Infertilità
Femmine
PROSCAR non è indicato per l'uso nelle donne.
Maschi
Il trattamento con PROSCAR per 24 settimane per valutare i parametri dello sperma in volontari maschi sani non ha rivelato effetti clinicamente significativi sulla concentrazione, mobilità, morfologia o pH degli spermatozoi. È stata osservata una diminuzione mediana di 0,6 ml (22,1%) del volume dell'eiaculato con una concomitante riduzione dello sperma totale per eiaculato. Questi parametri sono rimasti nell'intervallo normale ed erano reversibili dopo l'interruzione della terapia con un tempo medio per tornare al valore basale di 84 settimane [vedi AVVERTENZE E PRECAUZIONI ].
Ci sono state segnalazioni post-marketing di infertilità maschile e/o scarsa qualità seminale; la normalizzazione o il miglioramento della qualità seminale sono stati riportati dopo l'interruzione della finasteride [vedi REAZIONI AVVERSE ].
Uso pediatrico
PROSCAR 5 mg non è indicato per l'uso nei pazienti pediatrici.
La sicurezza e l'efficacia nei pazienti pediatrici non sono state stabilite.
Uso geriatrico
Del numero totale di soggetti inclusi in PLESS, 1480 e 105 soggetti erano rispettivamente 65 e più e 75 e più. Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra questi soggetti e i soggetti più giovani e altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e quelli più giovani. Non è necessario alcun aggiustamento del dosaggio negli anziani [vedi FARMACOLOGIA CLINICA  e Studi clinici ].
Insufficienza epatica
Si deve usare cautela nella somministrazione di PROSCAR in quei pazienti con anomalie della funzionalità epatica, poiché la finasteride viene ampiamente metabolizzata nel fegato [vedi FARMACOLOGIA CLINICA ].
Insufficienza renale
Non è necessario alcun aggiustamento del dosaggio nei pazienti con insufficienza renale [vedi FARMACOLOGIA CLINICA ].
OVERDOSE
I pazienti hanno ricevuto dosi singole di PROSCAR 5 mg fino a 400 mg e dosi multiple di PROSCAR 5 mg fino a 80 mg/die per tre mesi senza effetti avversi. Fino a quando non sarà acquisita ulteriore esperienza, non può essere raccomandato alcun trattamento specifico per un sovradosaggio con PROSCAR.
Letalità significativa è stata osservata in topi maschi e femmine a dosi orali singole di 1500 mg/m2 (500 mg/kg) e in ratti femmine e maschi a dosi orali singole di 2360 mg/m2 (400 mg/kg) e 5900 mg/m2 (1000 mg/kg), rispettivamente.
CONTROINDICAZIONI
PROSCAR è controindicato nei seguenti casi:
- Ipersensibilità a qualsiasi componente di questo farmaco.
- Gravidanza. L'uso di finasteride è controindicato nelle donne quando sono o potrebbero essere in gravidanza. A causa della capacità degli inibitori della 5α-reduttasi di tipo II di inibire la conversione del testosterone in 5α-diidrotestosterone (DHT), la finasteride può causare anomalie dei genitali esterni di un feto maschio di una donna incinta che riceve finasteride. Se questo farmaco viene utilizzato durante la gravidanza, o se si verifica una gravidanza durante l'assunzione di questo farmaco, la donna incinta deve essere informata del potenziale pericolo per il feto maschio. [Vedi anche AVVERTENZE E PRECAUZIONI ,UN Utilizzare in popolazioni specifiche , e COME FORNITO .] Nelle femmine di ratto, basse dosi di finasteride somministrate durante la gravidanza hanno prodotto anomalie dei genitali esterni nella prole maschile.
FARMACOLOGIA CLINICA
Meccanismo di azione
Lo sviluppo e l'allargamento della ghiandola prostatica dipendono dal potente androgeno, il 5α-diidrotestosterone (DHT). La 5α-reduttasi di tipo II metabolizza il testosterone in DHT nella ghiandola prostatica, nel fegato e nella pelle. Il DHT induce effetti androgeni legandosi ai recettori degli androgeni nei nuclei cellulari di questi organi.
La finasteride è un inibitore competitivo e specifico della 5α-reduttasi di tipo II con il quale forma lentamente un complesso enzimatico stabile. Il fatturato di questo complesso è estremamente lento (t½ ∼ 30 giorni). Ciò è stato dimostrato sia in vivo che in vitro. La finasteride non ha affinità per il recettore degli androgeni. Nell'uomo, i metaboliti steroidei 5α-ridotti nel sangue e nelle urine sono ridotti dopo la somministrazione di finasteride.
Farmacodinamica
Nell'uomo, una singola dose orale di 5 mg di PROSCAR produce una rapida riduzione della concentrazione sierica di DHT, con l'effetto massimo osservato 8 ore dopo la prima dose. La soppressione del DHT viene mantenuta durante l'intervallo di somministrazione di 24 ore e con il trattamento continuato. È stato dimostrato che la somministrazione giornaliera di PROSCAR a 5 mg/die per un massimo di 4 anni riduce la concentrazione sierica di DHT di circa il 70%. Il livello circolante mediano di testosterone è aumentato di circa il 10-20% ma è rimasto all'interno dell'intervallo fisiologico. In uno studio separato su uomini sani trattati con finasteride 1 mg al giorno (n=82) o placebo (n=69), i livelli circolanti medi di testosterone ed estradiolo sono aumentati di circa il 15% rispetto al basale, ma questi sono rimasti entro i limiti gamma fisiologica.
Nei pazienti trattati con PROSCAR 5 mg/die, sono stati osservati aumenti di circa il 10% dell'ormone luteinizzante (LH) e dell'ormone follicolo-stimolante (FSH), ma i livelli sono rimasti nell'intervallo normale. In volontari sani, il trattamento con PROSCAR 5 mg non ha alterato la risposta di LH e FSH all'ormone di rilascio delle gonadotropine, indicando che l'asse ipotalamo-ipofisi-testicolare non era influenzato.
Nei pazienti con IPB, PROSCAR non ha alcun effetto sui livelli circolanti di cortisolo, prolattina, ormone stimolante la tiroide o tiroxina. Non è stato osservato alcun effetto clinicamente significativo sul profilo lipidico plasmatico (cioè, colesterolo totale, lipoproteine a bassa densità, lipoproteine ad alta densità e trigliceridi) o sulla densità minerale ossea.
Anche i maschi adulti con deficit di 5α-reduttasi di tipo II geneticamente ereditato hanno livelli ridotti di DHT. Fatta eccezione per i difetti urogenitali associati presenti alla nascita, in questi soggetti non sono state osservate altre anomalie cliniche correlate al deficit di 5α-reduttasi di tipo II. Questi individui hanno una piccola ghiandola prostatica per tutta la vita e non sviluppano BPH.
Nei pazienti con IPB trattati con finasteride (1-100 mg/die) per 7-10 giorni prima della prostatectomia, è stato misurato un contenuto di DHT inferiore di circa l'80% nel tessuto prostatico rimosso chirurgicamente, rispetto al placebo; la concentrazione tissutale di testosterone è stata aumentata fino a 10 volte rispetto ai livelli di pretrattamento, rispetto al placebo. Anche il contenuto intraprostatico di PSA è stato ridotto.
In volontari maschi sani trattati con PROSCAR 5 mg per 14 giorni, l'interruzione della terapia ha comportato il ritorno dei livelli di DHT ai livelli di pretrattamento in circa 2 settimane. Nei pazienti trattati per tre mesi, il volume della prostata, che è diminuito di circa il 20%, è tornato vicino al valore basale dopo circa tre mesi di interruzione della terapia.
Farmacocinetica
Assorbimento
In uno studio su 15 giovani soggetti sani, la biodisponibilità media di finasteride compresse da 5 mg era del 63% (range 34-108%), in base al rapporto tra l'area sotto la curva (AUC) rispetto a una dose di riferimento endovenosa (IV) . La concentrazione plasmatica massima di finasteride era in media di 37 ng/mL (range, 27-49 ng/mL) ed è stata raggiunta 1-2 ore dopo la dose. La biodisponibilità della finasteride non è stata influenzata dal cibo.
Distribuzione
Il volume medio di distribuzione allo stato stazionario era di 76 litri (intervallo, 44-96 litri). Circa il 90% della finasteride circolante è legato alle proteine plasmatiche. C'è una fase di accumulo lenta per finasteride dopo dosi multiple. Dopo la somministrazione di 5 mg/die di finasteride per 17 giorni, le concentrazioni plasmatiche di finasteride erano superiori del 47 e del 54% rispetto alla prima dose negli uomini di età compresa tra 45 e 60 anni (n=12) e ≥70 anni (n=12) , rispettivamente. Le concentrazioni minime medie dopo 17 giorni di somministrazione erano rispettivamente di 6,2 ng/mL (intervallo, 2,49,8 ng/mL) e 8,1 ng/mL (intervallo, 1,8-19,7 ng/mL), nei due gruppi di età. Sebbene lo stato stazionario non sia stato raggiunto in questo studio, la concentrazione plasmatica minima media in un altro studio in pazienti con IPB (età media, 65 anni) che hanno ricevuto 5 mg/die è stata di 9,4 ng/mL (intervallo, 7,1-13,3 ng/mL; n= 22) dopo oltre un anno di somministrazione.
È stato dimostrato che la finasteride attraversa la barriera ematoencefalica ma non sembra distribuirsi preferenzialmente al liquido cerebrospinale.
In 2 studi su soggetti sani (n=69) trattati con PROSCAR 5 mg/die per 6-24 settimane, le concentrazioni di finasteride nel liquido seminale variavano da non rilevabili ( Utilizzare in popolazioni specifiche ].
Metabolismo
La finasteride è ampiamente metabolizzata nel fegato, principalmente attraverso la sottofamiglia enzimatica del citocromo P450 3A4. Sono stati identificati due metaboliti, i metaboliti dell'acido monoidrossilato della catena laterale t-butile e dell'acido monocarbossilico, che non possiedono più del 20% dell'attività inibitoria della 5α-reduttasi della finasteride.
Escrezione
In soggetti giovani sani (n=15), la clearance plasmatica media della finasteride era di 165 ml/min (range, 70279 ml/min) e l'emivita plasmatica media di eliminazione era di 6 ore (range, 3-16 ore). Dopo una dose orale di 14C-finasteride nell'uomo (n=6), una media del 39% (intervallo, 32-46%) della dose è stata escreta nelle urine sotto forma di metaboliti; Il 57% (intervallo, 51-64%) è stato escreto con le feci.
L'emivita terminale media della finasteride nei soggetti di età ≥70 anni era di circa 8 ore (intervallo, 6-15 ore; n=12), rispetto a 6 ore (intervallo, 4-12 ore; n=12) nei soggetti 45-60 anni di età. Di conseguenza, l'AUC media (0-24 ore) dopo 17 giorni di somministrazione era del 15% più alta nei soggetti di età ≥70 anni rispetto ai soggetti di età compresa tra 45 e 60 anni (p=0,02).
pediatrico
La farmacocinetica della finasteride non è stata studiata in pazienti di età inferiore ai 18 anni.
La finasteride non è indicata per l'uso nei pazienti pediatrici [vedi AVVERTENZE E PRECAUZIONI ,UN Utilizzare in popolazioni specifiche ].
Genere
La finasteride non è indicata per l'uso nelle donne [vedi CONTROINDICAZIONI ,UN AVVERTENZE E PRECAUZIONI ,UN Utilizzare in popolazioni specifiche , e COME FORNITO ].
geriatrico
Non è necessario alcun aggiustamento del dosaggio negli anziani. Sebbene il tasso di eliminazione della finasteride sia diminuito negli anziani, questi risultati non hanno alcun significato clinico. [Vedere un Farmacocinetica  e Utilizzare in popolazioni specifiche .]
Gara
L'effetto della razza sulla farmacocinetica della finasteride non è stato studiato.
Insufficienza epatica
L'effetto dell'insufficienza epatica sulla farmacocinetica della finasteride non è stato studiato. Si deve usare cautela nella somministrazione di PROSCAR 5 mg in quei pazienti con anomalie della funzionalità epatica, poiché la finasteride è ampiamente metabolizzata nel fegato. Insufficienza renale
Non è necessario alcun aggiustamento del dosaggio nei pazienti con insufficienza renale. Nei pazienti con insufficienza renale cronica, con clearance della creatinina compresa tra 9,0 e 55 ml/min, l'AUC, la concentrazione plasmatica massima, l'emivita e il legame proteico dopo una singola dose di 14C-finasteride erano simili ai valori ottenuti in volontari sani. L'escrezione urinaria dei metaboliti è stata ridotta nei pazienti con insufficienza renale. Questa diminuzione è stata associata ad un aumento dell'escrezione fecale dei metaboliti. Le concentrazioni plasmatiche dei metaboliti erano significativamente più elevate nei pazienti con insufficienza renale (sulla base di un aumento del 60% dell'AUC della radioattività totale). Tuttavia, la finasteride è stata ben tollerata nei pazienti con IPB con funzionalità renale normale che hanno ricevuto fino a 80 mg/die per 12 settimane, dove l'esposizione di questi pazienti ai metaboliti sarebbe presumibilmente molto maggiore.
Studi clinici
Monoterapia
PROSCAR 5 mg/die è stato inizialmente valutato in pazienti con sintomi di IPB e ingrossamento della prostata mediante esame rettale digitale in due studi randomizzati, in doppio cieco, controllati con placebo, della durata di 1 anno e le loro estensioni in aperto di 5 anni.
PROSCAR 5 mg è stato ulteriormente valutato nel PROSCAR Long-Term Efficacy and Safety Study (PLESS), uno studio multicentrico in doppio cieco, randomizzato, controllato con placebo, della durata di 4 anni. 3040 pazienti di età compresa tra 45 e 78 anni, con sintomi da moderati a gravi di IPB e un ingrossamento della prostata all'esame rettale digitale, sono stati randomizzati nello studio (1524 alla finasteride, 1516 al placebo) e 3016 pazienti erano valutabili per l'efficacia. 1883 pazienti hanno completato lo studio di 4 anni (1000 nel gruppo finasteride, 883 nel gruppo placebo).
Effetto sul punteggio dei sintomi
sintomi sono stati quantificati utilizzando un punteggio simile all'American Urological Association Symptom Score, che ha valutato sia i sintomi ostruttivi (alterazione delle dimensioni e della forza del flusso, sensazione di svuotamento incompleto della vescica, minzione ritardata o interrotta) sia i sintomi irritativi (nicturia, frequenza diurna, necessità per sforzare o spingere il flusso di urina) valutando una scala da 0 a 5 per sei sintomi e una scala da 0 a 4 per un sintomo, per un punteggio totale possibile di 34.
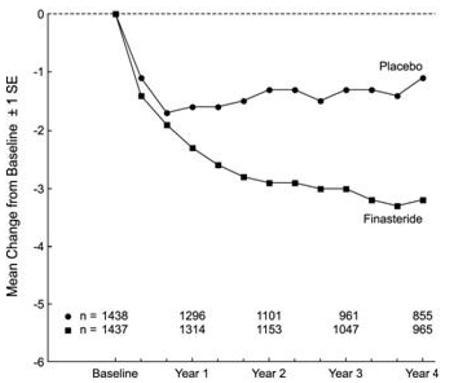
I pazienti in PLESS presentavano sintomi da moderati a gravi al basale (media di circa 15 punti su una scala da 0 a 34 punti). I pazienti randomizzati a PROSCAR che sono rimasti in terapia per 4 anni hanno avuto una riduzione media (± 1 DS) del punteggio dei sintomi di 3,3 (± 5,8) punti rispetto a 1,3 (± 5,6) punti nel gruppo placebo. (Vedere la figura 1.) Un miglioramento statisticamente significativo nel punteggio dei sintomi è stato evidente a 1 anno nei pazienti trattati con PROSCAR rispetto al placebo (–2,3 vs –1,6), e questo miglioramento è continuato per tutto l'anno 4.
Figura 1 Punteggio dei sintomi in PLESS
I risultati osservati in studi precedenti erano paragonabili a quelli osservati in PLESS. Sebbene in alcuni pazienti sia stato osservato un miglioramento precoce dei sintomi urinari, è stato generalmente necessario uno studio terapeutico di almeno 6 mesi per valutare se fosse stata ottenuta una risposta benefica nel sollievo dei sintomi. Il miglioramento dei sintomi dell'IPB è stato osservato durante il primo anno e mantenuto durante altri 5 anni di studi di estensione aperti.
Effetto sulla ritenzione urinaria acuta e sulla necessità di un intervento chirurgico
In PLESS, l'efficacia è stata valutata anche valutando i fallimenti del trattamento. Il fallimento del trattamento è stato prospetticamente definito come eventi urologici correlati all'IPB o deterioramento clinico, mancanza di miglioramento e/o necessità di una terapia alternativa. Gli eventi urologici correlati all'IPB sono stati definiti come intervento chirurgico urologico e ritenzione urinaria acuta che richiedeva il cateterismo. Informazioni complete sull'evento erano disponibili per il 92% dei pazienti. La tabella seguente (Tabella 5) riassume i risultati.
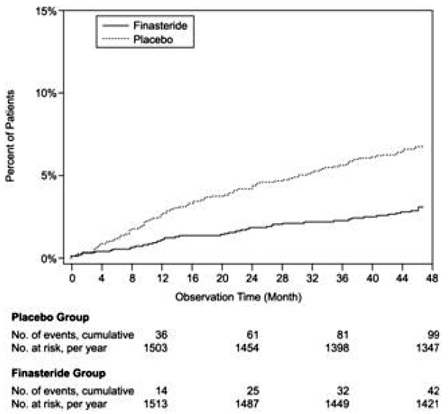
Rispetto al placebo, PROSCAR era associato a un rischio significativamente più basso di ritenzione urinaria acuta o alla necessità di un intervento chirurgico correlato all'IPB [13,2% per il placebo vs 6,6% per PROSCAR; 51% di riduzione del rischio, IC 95%: (da 34 a 63%)]. Rispetto al placebo, PROSCAR 5 mg è stato associato a un rischio significativamente più basso di intervento chirurgico [10,1% per il placebo vs 4,6% per PROSCAR; 55% di riduzione del rischio, IC 95%: (da 37 a 68%)] e con un rischio significativamente più basso di ritenzione urinaria acuta [6,6% per il placebo vs 2,8% per PROSCAR; 57% di riduzione del rischio, IC 95%: (da 34 a 72%]; vedere le figure 2 e 3.
Figura 2 Percentuale di pazienti sottoposti a intervento chirurgico per BPH, inclusa la TURP
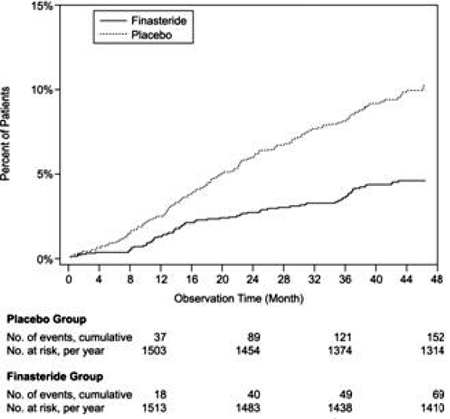
Figura 3 Percentuale di pazienti che sviluppano ritenzione urinaria acuta (spontanea e precipitata)
Effetto sulla portata urinaria massima
Nei pazienti in PLESS che sono rimasti in terapia per la durata dello studio e avevano dati sul flusso urinario valutabili, PROSCAR 5 mg ha aumentato la velocità del flusso urinario massimo di 1,9 ml/sec rispetto a 0,2 ml/sec nel gruppo placebo.
C'era una chiara differenza tra i gruppi di trattamento nella portata urinaria massima a favore di PROSCAR 5 mg entro il mese 4 (1,0 vs 0,3 ml/sec) che è stata mantenuta per tutto lo studio. Nei primi studi di 1 anno, l'aumento della portata urinaria massima era paragonabile a PLESS ed è stato mantenuto per tutto il primo anno e per altri 5 anni di studi di estensione aperti.
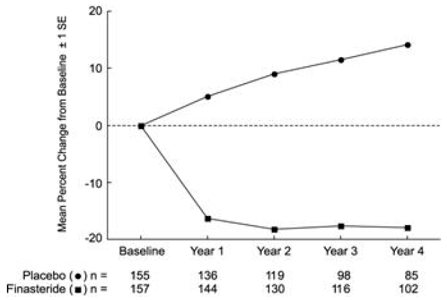
Effetto sul volume della prostata
In PLESS, il volume della prostata è stato valutato annualmente mediante risonanza magnetica (MRI) in un sottogruppo di pazienti. Nei pazienti trattati con PROSCAR 5 mg che sono rimasti in terapia, il volume della prostata è stato ridotto rispetto sia al basale che al placebo durante lo studio di 4 anni. PROSCAR ha ridotto il volume della prostata del 17,9% (da 55,9 cc al basale a 45,8 cc a 4 anni) rispetto a un aumento del 14,1% (da 51,3 cc a 58,5 cc) nel gruppo placebo (p
I risultati osservati in studi precedenti erano paragonabili a quelli osservati in PLESS. Il volume medio della prostata al basale variava tra 40-50 cc. La riduzione del volume della prostata è stata osservata durante il primo anno e mantenuta per altri cinque anni di studi di estensione aperti.
Figura 4 Volume della prostata in PLESS
Volume della prostata come predittore della risposta terapeutica
Una meta-analisi che combina i dati a 1 anno di sette studi in doppio cieco, controllati con placebo di disegno simile, inclusi 4491 pazienti con IPB sintomatico, ha dimostrato che, nei pazienti trattati con PROSCAR, l'entità della risposta sintomatica e il grado di miglioramento nella massima la portata urinaria era maggiore nei pazienti con ingrossamento della prostata al basale.
Combinazione con terapia alfa-bloccante
Lo studio sulla terapia medica dei sintomi prostatici (MTOPS) era uno studio multicentrico, in doppio cieco, randomizzato, controllato con placebo, della durata di 4-6 anni (in media 5 anni) su 3047 uomini con BPH sintomatico, randomizzati a ricevere PROSCAR 5 mg/die (n=768), doxazosina 4 o 8 mg/die (n=756), la combinazione di PROSCAR 5 mg/die e doxazosina 4 o 8 mg/die (n=786) o placebo (n=737 ). Tutti i partecipanti sono stati sottoposti a titolazione settimanale di doxazosina (o del suo placebo) da 1 a 2 a 4 a 8 mg/die. Solo coloro che hanno tollerato il livello di dose di 4 o 8 mg sono stati mantenuti in doxazosina (o il suo placebo) nello studio. La dose finale tollerata del partecipante (4 mg o 8 mg) è stata somministrata a partire dalla fine della settimana 4. La dose finale di doxazosina è stata somministrata una volta al giorno, prima di coricarsi.
L'età media dei pazienti alla randomizzazione era di 62,6 anni (±7,3 anni). I pazienti erano caucasici (82%), afroamericani (9%), ispanici (7%), asiatici (1%) o nativi americani (
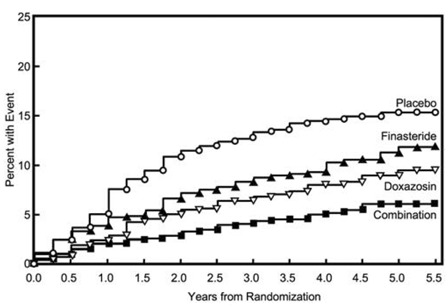
L'endpoint primario era una misura composita della prima occorrenza di uno qualsiasi dei seguenti cinque esiti: un aumento confermato ≥4 punti rispetto al basale del punteggio dei sintomi, ritenzione urinaria acuta, insufficienza renale correlata all'IPB (aumento della creatinina), infezioni ricorrenti del tratto urinario o urosepsi, o incontinenza. Rispetto al placebo, il trattamento con PROSCAR 5 mg, doxazosina o terapia di combinazione ha comportato una riduzione del rischio di sperimentare uno di questi cinque eventi di esito del 34% (p=0,002), 39% (p
La maggior parte degli eventi (274 su 351; 78%) è stata un aumento confermato di ≥4 punti del punteggio dei sintomi, denominato progressione del punteggio dei sintomi. Il rischio di progressione del punteggio dei sintomi è stato ridotto del 30% (p=0,016), 46% (p
Figura 5 Incidenza cumulativa di un aumento di 4 punti nel punteggio dei sintomi AUA per gruppo di trattamento
Il trattamento con PROSCAR 5 mg, doxazosina o la combinazione di PROSCAR con doxazosina ha ridotto il punteggio medio dei sintomi rispetto al basale all'anno 4. La tabella 7 fornisce la variazione media rispetto al basale per il punteggio dei sintomi AUA per gruppo di trattamento per i pazienti che sono rimasti in terapia per quattro anni.
risultati di MTOPS sono coerenti con i risultati dello studio PLESS di 4 anni, controllato con placebo [vedi Monoterapia ] in quel trattamento con PROSCAR riduce il rischio di ritenzione urinaria acuta e la necessità di un intervento chirurgico correlato all'IPB. In MTOPS, il rischio di sviluppare ritenzione urinaria acuta è stato ridotto del 67% nei pazienti trattati con PROSCAR rispetto ai pazienti trattati con placebo (0,8% per PROSCAR e 2,4% per placebo). Inoltre, il rischio di richiedere una terapia invasiva correlata all'IPB è stato ridotto del 64% nei pazienti trattati con PROSCAR rispetto ai pazienti trattati con placebo (2,0% per PROSCAR 5 mg e 5,4% per placebo).
Riassunto degli studi clinici
I dati di questi studi, che mostrano il miglioramento dei sintomi correlati all'IPB, la riduzione del fallimento del trattamento (eventi urologici correlati all'IPB), l'aumento dei flussi urinari massimi e la diminuzione del volume della prostata, suggeriscono che PROSCAR arresti il processo patologico dell'IPB negli uomini con un prostata ingrossata.
INFORMAZIONI PER IL PAZIENTE
Nessuna informazione fornita. Si prega di fare riferimento al AVVERTENZE E PRECAUZIONI sezione.
