Trattamenti Capelli: Avodart 0.5mg Dutasteride Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Che cos'è Avodart 0,5 mg e come viene utilizzato?
Avodart 0,5 mg è un medicinale su prescrizione usato per trattare i sintomi di un ingrossamento della prostata (iperplasia prostatica benigna). Avodart può essere usato da solo o con altri farmaci.
Avodart 0,5 mg appartiene a una classe di farmaci chiamati inibitori della 5-alfa-reduttasi.
Non è noto se Avodart 0,5 mg sia sicuro ed efficace nei bambini.
Quali sono gli effetti collaterali di Avodart?
Gli effetti collaterali di Avodart 0,5 mg includono:
- orticaria,
- respirazione difficoltosa,
- gonfiore al viso o alla gola,
- febbre,
- mal di gola,
- occhi ardenti,
- dolore alla pelle, e
- eruzione cutanea rossa o violacea con vesciche e desquamazione
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Avodart 0,5 mg includono:
- diminuzione della libido (impulso sessuale),
- diminuzione della quantità di sperma rilasciato durante il sesso,
- impotenza (problemi a ottenere o mantenere un'erezione) e
- tenerezza o ingrossamento del seno
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Avodart. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
AVODART 0,5 mg è un composto sintetico di 4-azasteroidi che è un inibitore selettivo delle isoforme di tipo 1 e di tipo 2 della steroide 5 alfa-reduttasi, un enzima intracellulare che converte il testosterone in DHT.
La dutasteride è chimicamente designata come (5α,17β)-N-{2,5 bis(trifluorometil)fenil}-3-osso-4-azaandrost-1-ene-17-carbossammide. La formula empirica della dutasteride è C27H30F6N2O2, che rappresenta un peso molecolare di 528,5 con la seguente formula strutturale:
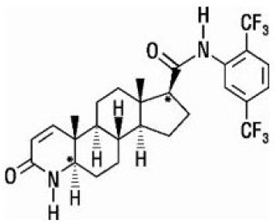
La dutasteride è una polvere di colore da bianco a giallo pallido con un punto di fusione da 242° a 250°C. È solubile in etanolo (44 mg/mL), metanolo (64 mg/mL) e polietilenglicole 400 (3 mg/mL), ma è insolubile in acqua.
Ciascuna capsula di gelatina molle AVODART da 0,5 mg, somministrata per via orale, contiene 0,5 mg di dutasteride disciolto in una miscela di mono-digliceridi di acido caprilico/caprico e idrossitoluene butilato. Gli eccipienti inattivi nell'involucro della capsula sono ossido ferrico (giallo), gelatina (da fonti bovine certificate esenti da BSE), glicerina e biossido di titanio. Le capsule di gelatina morbida sono stampate con inchiostro rosso commestibile.
INDICAZIONI
Monoterapia
Le capsule di gelatina molle AVODART (dutasteride) sono indicate per il trattamento dell'iperplasia prostatica benigna (IPB) sintomatica negli uomini con ingrossamento della prostata a:
- migliorare i sintomi,
- ridurre il rischio di ritenzione urinaria acuta (AUR) e
- ridurre il rischio della necessità di un intervento chirurgico correlato all'IPB.
Combinazione con l'antagonista alfa-adrenergico
AVODART in combinazione con l'antagonista alfa-adrenergico, tamsulosina, è indicato per il trattamento dell'IPB sintomatico negli uomini con ingrossamento della prostata.
Limitazioni d'uso
AVODART 0,5 mg non è approvato per la prevenzione del cancro alla prostata.
DOSAGGIO E SOMMINISTRAZIONE
Le capsule devono essere ingerite intere e non masticate o aperte, poiché il contatto con il contenuto della capsula può provocare irritazione della mucosa orofaringea. AVODART può essere somministrato con o senza cibo.
Monoterapia
La dose raccomandata di AVODART è 1 capsula (0,5 mg) assunta una volta al giorno.
Combinazione con l'antagonista alfa-adrenergico
La dose raccomandata di AVODART 0,5 mg è 1 capsula (0,5 mg) assunta una volta al giorno e tamsulosina 0,4 mg assunta una volta al giorno.
COME FORNITO
Forme di dosaggio e punti di forza
Capsule di gelatina da 0,5 mg, opache, di colore giallo opaco, con impresso “GX CE2” in inchiostro rosso su un lato.
Stoccaggio e manipolazione
AVODART capsule di gelatina molle da 0,5 mg sono capsule di gelatina oblunghe, opache, di colore giallo opaco con impresso “GX CE2” con inchiostro commestibile rosso su un lato, confezionate in flaconi da 30 ( NDC 0173-0712-15) e 90 ( NDC 0173-0712-04) con chiusure a prova di bambino.
Conservare a 25°C (77°F); escursioni consentite da 15° a 30°C (da 59° a 86°F) [vedi Temperatura ambiente controllata USP ].
La dutasteride viene assorbita attraverso la pelle. Le capsule di AVODART 0,5 mg non devono essere maneggiate da donne in gravidanza o che potrebbero iniziare una gravidanza a causa del potenziale assorbimento di dutasteride e del conseguente potenziale rischio per lo sviluppo di un feto maschio [vedere AVVERTENZE E PRECAUZIONI ].
Prodotto per: GlaxoSmithKline Research Triangle Park. Revisionato: gennaio 2020
EFFETTI COLLATERALI
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
Da studi clinici con AVODART 0,5 mg in monoterapia o in combinazione con tamsulosina:
- Le reazioni avverse più comuni riportate nei soggetti che hanno ricevuto AVODART 0,5 mg sono state impotenza, diminuzione della libido, disturbi della mammella (inclusi ingrossamento e dolorabilità del seno) e disturbi dell'eiaculazione. Le reazioni avverse più comuni riportate nei soggetti in terapia di associazione (AVODART 0,5 mg più tamsulosina) sono state impotenza, diminuzione della libido, disturbi della mammella (inclusi ingrossamento e dolorabilità del seno), disturbi dell'eiaculazione e capogiri. I disturbi dell'eiaculazione si sono verificati significativamente di più nei soggetti che hanno ricevuto la terapia di combinazione (11%) rispetto a quelli che hanno ricevuto AVODART (2%) o tamsulosina (4%) in monoterapia.
- La sospensione dello studio a causa di reazioni avverse si è verificata nel 4% dei soggetti che hanno ricevuto AVODART 0,5 mg e nel 3% dei soggetti che hanno ricevuto placebo negli studi controllati con placebo con AVODART. La reazione avversa più comune che ha portato al ritiro dello studio è stata l'impotenza (1%).
- Nello studio clinico di valutazione della terapia di associazione, la sospensione dello studio a causa di reazioni avverse si è verificata nel 6% dei soggetti che hanno ricevuto la terapia di associazione (AVODART più tamsulosina) e nel 4% dei soggetti che hanno ricevuto AVODART 0,5 mg o tamsulosina in monoterapia. La reazione avversa più comune in tutti i bracci di trattamento che ha portato alla sospensione dello studio è stata la disfunzione erettile (da 1% a 1,5%).
Monoterapia
Oltre 4.300 soggetti di sesso maschile con BPH sono stati assegnati in modo casuale a ricevere placebo o dosi giornaliere di 0,5 mg di AVODART in 3 studi di trattamento di Fase 3 identici, di 2 anni, controllati con placebo, in doppio cieco, ciascuno seguito da uno in aperto di 2 anni estensione. Durante il periodo di trattamento in doppio cieco, 2.167 soggetti maschi sono stati esposti ad AVODART 0,5 mg, di cui 1.772 esposti per 1 anno e 1.510 esposti per 2 anni. Includendo le estensioni in aperto, 1.009 soggetti maschi sono stati esposti ad AVODART 0,5 mg per 3 anni e 812 sono stati esposti per 4 anni. La popolazione aveva un'età compresa tra 47 e 94 anni (età media: 66 anni) e più del 90% era bianco. La tabella 1 riassume le reazioni avverse cliniche riportate in almeno l'1% dei soggetti trattati con AVODART e con un'incidenza maggiore rispetto ai soggetti trattati con placebo.
Trattamento a lungo termine (fino a 4 anni)
Cancro alla prostata di alto grado
Lo studio REDUCE era uno studio randomizzato, in doppio cieco, controllato con placebo che ha arruolato 8.231 uomini di età compresa tra 50 e 75 anni con un PSA sierico compreso tra 2,5 ng/mL e 10 ng/mL e una biopsia prostatica negativa nei 6 mesi precedenti. I soggetti sono stati randomizzati a ricevere placebo (n = 4.126) o dosi giornaliere di 0,5 mg di AVODART (n = 4.105) per un massimo di 4 anni. L'età media era di 63 anni e il 91% era bianco. I soggetti sono stati sottoposti a biopsie prostatiche programmate prescritte dal protocollo a 2 e 4 anni di trattamento o hanno avuto "biopsie per causa" in orari non programmati se clinicamente indicato. C'è stata una maggiore incidenza di cancro alla prostata con punteggio di Gleason 8-10 negli uomini trattati con AVODART (1,0%) rispetto agli uomini trattati con placebo (0,5%) [vedere INDICAZIONI E UTILIZZO , AVVERTENZE E PRECAUZIONI ]. In uno studio clinico di 7 anni controllato con placebo con un altro inibitore della 5 alfa-reduttasi (finasteride 5 mg, PROSCAR), sono stati osservati risultati simili per il cancro alla prostata con punteggio di Gleason 8-10 (finasteride 1,8% contro placebo 1,1%).
Nessun beneficio clinico è stato dimostrato nei pazienti con cancro alla prostata trattati con AVODART.
Disturbi della riproduzione e della mammella
Nei 3 studi cardine controllati con placebo sull'IPB con AVODART 0,5 mg, della durata di 4 anni ciascuno, non sono emerse evidenze di aumento delle reazioni avverse sessuali (impotenza, diminuzione della libido e disturbo dell'eiaculazione) o disturbi della mammella con aumento della durata del trattamento. Tra questi 3 studi, c'era 1 caso di cancro al seno nel gruppo dutasteride e 1 caso nel gruppo placebo. Non sono stati segnalati casi di cancro al seno in nessun gruppo di trattamento nello studio CombAT di 4 anni o nello studio REDUCE di 4 anni.
La relazione tra l'uso a lungo termine di dutasteride e la neoplasia mammaria maschile è attualmente sconosciuta.
Combinazione con terapia alfa-bloccante (CombAT)
Oltre 4.800 soggetti di sesso maschile con BPH sono stati assegnati in modo casuale a ricevere 0,5 mg di AVODART 0,5 mg, 0,4 mg di tamsulosina o una terapia di combinazione (0,5 mg di AVODART più 0,4 mg di tamsulosina) somministrata una volta al giorno in uno studio in doppio cieco di 4 anni. Complessivamente, 1.623 soggetti hanno ricevuto la monoterapia con AVODART; 1.611 soggetti hanno ricevuto la monoterapia con tamsulosina; e 1.610 soggetti hanno ricevuto la terapia di combinazione. La popolazione aveva un'età compresa tra 49 e 88 anni (età media: 66 anni) e l'88% era bianco. La tabella 2 riassume le reazioni avverse riportate in almeno l'1% dei soggetti nel gruppo di associazione e con un'incidenza maggiore rispetto ai soggetti trattati in monoterapia con AVODART 0,5 mg o tamsulosina.
Insufficienza cardiaca
In CombAT, dopo 4 anni di trattamento, l'incidenza dell'insufficienza cardiaca a termine composito nel gruppo della terapia di combinazione (12/1.610; 0,7%) era maggiore rispetto a entrambi i gruppi in monoterapia: AVODART 0,5 mg, 2/1.623 (0,1%) e tamsulosina, 9/1.611 (0,6%). L'insufficienza cardiaca composita è stata anche esaminata in uno studio separato di 4 anni controllato con placebo che ha valutato AVODART negli uomini a rischio di sviluppo di cancro alla prostata. L'incidenza di insufficienza cardiaca nei soggetti che assumevano AVODART 0,5 mg è stata dello 0,6% (26/4.105) rispetto allo 0,4% (15/4.126) nei soggetti trattati con placebo. La maggior parte dei soggetti con insufficienza cardiaca in entrambi gli studi presentava comorbidità associate ad un aumentato rischio di insufficienza cardiaca. Pertanto, il significato clinico degli squilibri numerici nell'insufficienza cardiaca è sconosciuto. Non è stata stabilita alcuna relazione causale tra AVODART da solo o in associazione con tamsulosina e insufficienza cardiaca. Nessuno squilibrio è stato osservato nell'incidenza degli eventi avversi cardiovascolari complessivi in nessuno dei due studi.
Esperienza di post marketing
Le seguenti reazioni avverse sono state identificate durante l'uso successivo all'approvazione di AVODART. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco. Queste reazioni sono state scelte per l'inclusione a causa di una combinazione della loro gravità, frequenza di segnalazione o potenziale nesso causale con AVODART.
Disturbi del sistema immunitario
Reazioni di ipersensibilità, inclusi rash, prurito, orticaria, edema localizzato, reazioni cutanee gravi e angioedema.
Neoplasie
Cancro al seno maschile.
Disturbi psichiatrici
Umore depresso.
Disturbi dell'apparato riproduttivo e della mammella
Dolore ai testicoli e gonfiore ai testicoli.
INTERAZIONI DI DROGA
Inibitori del citocromo P450 3A
La dutasteride è ampiamente metabolizzata nell'uomo dagli isoenzimi del citocromo P450 (CYP)3A4 e CYP3A5. L'effetto di potenti inibitori del CYP3A4 sulla dutasteride non è stato studiato. A causa delle potenziali interazioni farmacologiche, usare cautela quando si prescrive AVODART a pazienti che assumono potenti inibitori cronici dell'enzima CYP3A4 (p. es., ritonavir) [vedere FARMACOLOGIA CLINICA ].
Antagonisti alfa-adrenergici
La somministrazione di AVODART in associazione con tamsulosina o terazosina non ha alcun effetto sulla farmacocinetica allo stato stazionario di nessuno dei due antagonisti alfa-adrenergici. L'effetto della somministrazione di tamsulosina o terazosina sui parametri farmacocinetici della dutasteride non è stato valutato.
Antagonisti del canale del calcio
La somministrazione concomitante di verapamil o diltiazem riduce la clearance della dutasteride e porta ad una maggiore esposizione alla dutasteride. La variazione dell'esposizione alla dutasteride non è considerata clinicamente significativa. Non è raccomandato alcun aggiustamento della dose [vedi FARMACOLOGIA CLINICA ].
colestiramina
La somministrazione di una singola dose da 5 mg di AVODART 0,5 mg seguita 1 ora dopo da 12 g di colestiramina non influisce sulla relativa biodisponibilità di dutasteride [vedere FARMACOLOGIA CLINICA ].
Digossina
AVODART 0,5 mg non altera la farmacocinetica allo stato stazionario della digossina quando somministrata in concomitanza a una dose di 0,5 mg/die per 3 settimane [vedere FARMACOLOGIA CLINICA ].
Warfarin
La somministrazione concomitante di AVODART 0,5 mg/die per 3 settimane con warfarin non altera la farmacocinetica allo stato stazionario degli isomeri S- o R-warfarin né altera l'effetto del warfarin sul tempo di protrombina [vedere FARMACOLOGIA CLINICA ].
AVVERTENZE
Incluso come parte del PRECAUZIONI sezione.
PRECAUZIONI
Effetti sull'antigene prostatico specifico (PSA) e sull'uso del PSA nella rilevazione del cancro alla prostata
Negli studi clinici, AVODART 0,5 mg ha ridotto la concentrazione sierica di PSA di circa il 50% entro 3-6 mesi dal trattamento. Questa diminuzione era prevedibile sull'intero intervallo dei valori di PSA nei soggetti con BPH sintomatico, sebbene possa variare negli individui. AVODART 0,5 mg può anche causare riduzioni del PSA sierico in presenza di cancro alla prostata. Per interpretare i PSA seriali negli uomini che assumono AVODART 0,5 mg, deve essere stabilito un nuovo PSA basale almeno 3 mesi dopo l'inizio del trattamento e successivamente monitorato periodicamente il PSA. Qualsiasi aumento confermato dal valore di PSA più basso durante l'assunzione di AVODART può segnalare la presenza di cancro alla prostata e deve essere valutato, anche se i livelli di PSA sono ancora entro l'intervallo normale per gli uomini che non assumono un inibitore della 5 alfareduttasi. Il mancato rispetto di AVODART può anche influenzare i risultati del test PSA.
Per interpretare un valore di PSA isolato in un uomo trattato con AVODART 0,5 mg per 3 mesi o più, il valore di PSA deve essere raddoppiato per il confronto con i valori normali negli uomini non trattati. Il rapporto PSA libero-totale (PSA libero percentuale) rimane costante, anche sotto l'influenza di AVODART. Se i medici scelgono di utilizzare la percentuale di PSA libero come ausilio nell'individuazione del cancro alla prostata negli uomini che ricevono AVODART, non sembra necessario alcun aggiustamento del suo valore.
La somministrazione concomitante di dutasteride e tamsulosina ha determinato variazioni del PSA sierico simili a quelle della monoterapia con dutasteride.
Aumento del rischio di cancro alla prostata di alto grado
Negli uomini di età compresa tra 50 e 75 anni con una precedente biopsia negativa per cancro alla prostata e un PSA basale compreso tra 2,5 ng/mL e 10,0 ng/mL che assumevano AVODART nello studio REDUCE (Reduction by Dutasteride of Prostate Cancer Events), è stato riscontrato un'aumentata incidenza di cancro alla prostata con punteggio di Gleason 810 rispetto agli uomini che assumevano placebo (AVODART 1,0% contro placebo 0,5%) [vedi INDICAZIONI E UTILIZZO , REAZIONI AVVERSE ]. In uno studio clinico di 7 anni controllato con placebo con un altro inibitore della 5 alfa-reduttasi (finasteride 5 mg, PROSCAR), sono stati osservati risultati simili per il cancro alla prostata con punteggio di Gleason 8-10 (finasteride 1,8% contro placebo 1,1%).
Gli inibitori della 5 alfa-reduttasi possono aumentare il rischio di sviluppo di cancro alla prostata di alto grado. Non è stato stabilito se l'effetto degli inibitori della 5 alfa-reduttasi sulla riduzione del volume della prostata o fattori correlati allo studio abbia influenzato i risultati di questi studi.
Valutazione per altre malattie urologiche
Prima di iniziare il trattamento con AVODART 0,5 mg, è necessario prendere in considerazione altre condizioni urologiche che possono causare sintomi simili. Inoltre, l'IPB e il cancro alla prostata possono coesistere.
Esposizione transdermica di AVODART 0,5 mg nelle donne in gravidanza: rischio per il feto maschio
Le capsule di AVODART non devono essere maneggiate da donne in gravidanza o che potrebbero essere in gravidanza. La dutasteride può essere assorbita attraverso la pelle e potrebbe causare un'esposizione fetale non intenzionale e un potenziale rischio per un feto maschio. Se una donna incinta entra in contatto con capsule di dutasteride che perdono, l'area di contatto deve essere lavata immediatamente con acqua e sapone [vedi Utilizzare in popolazioni specifiche ]. La dutasteride può essere assorbita attraverso la pelle sulla base di studi sugli animali [vedi Tossicologia non clinica ].
Donazione di sangue
Gli uomini in trattamento con AVODART non devono donare sangue prima che siano trascorsi almeno 6 mesi dall'ultima dose. Lo scopo di questo periodo differito è prevenire la somministrazione di dutasteride a una donna incinta che riceve una trasfusione.
Effetto sulle caratteristiche dello sperma
Gli effetti di dutasteride 0,5 mg/die sulle caratteristiche dello sperma sono stati valutati in uomini sani durante 52 settimane di trattamento e 24 settimane di follow-up post-trattamento. A 52 settimane, rispetto al placebo, il trattamento con dutasteride ha comportato una riduzione media della conta spermatica totale, del volume dello sperma e della motilità degli spermatozoi; gli effetti sulla conta spermatica totale non erano reversibili dopo 24 settimane di follow-up. La concentrazione dello sperma e la morfologia dello sperma non sono state influenzate ei valori medi per tutti i parametri dello sperma sono rimasti all'interno dell'intervallo normale in tutti i punti temporali. Il significato clinico dell'effetto della dutasteride sulle caratteristiche dello sperma per la fertilità di un singolo paziente non è noto [vedi Utilizzare in popolazioni specifiche ].
Informazioni di consulenza per il paziente
Consigliare al paziente di leggere l'etichettatura del paziente approvata dalla FDA ( INFORMAZIONI PER IL PAZIENTE ).
Monitoraggio PSA
Informare i pazienti che AVODART riduce i livelli sierici di PSA di circa il 50% entro 3-6 mesi dalla terapia, sebbene possa variare da individuo a individuo. Per i pazienti sottoposti a screening del PSA, l'aumento dei livelli di PSA durante il trattamento con AVODART può segnalare la presenza di cancro alla prostata e deve essere valutato da un operatore sanitario [vedi AVVERTENZE E PRECAUZIONI ].
Aumento del rischio di cancro alla prostata di alto grado
Informare i pazienti che c'è stato un aumento del cancro alla prostata di alto grado negli uomini trattati con 5 inibitori dell'alfa-reduttasi (indicati per il trattamento dell'IPB), incluso AVODART 0,5 mg, rispetto a quelli trattati con placebo negli studi sull'uso di questi farmaci per ridurre il rischio di cancro alla prostata [vedi INDICAZIONI E UTILIZZO , AVVERTENZE E PRECAUZIONI , REAZIONI AVVERSE ].
Esposizione transdermica di AVODART in donne in gravidanza o potenzialmente in gravidanza: rischio per il feto maschio
Informare i pazienti che le capsule di AVODART 0,5 mg non devono essere maneggiate da donne in gravidanza o potenzialmente in gravidanza a causa del potenziale assorbimento di dutasteride e del conseguente potenziale rischio per lo sviluppo di un feto maschio. La dutasteride può essere assorbita attraverso la pelle e potrebbe causare un'esposizione fetale indesiderata. Se una donna incinta o potenzialmente incinta entra in contatto con le capsule di AVODART 0,5 mg che perdono, l'area di contatto deve essere lavata immediatamente con acqua e sapone [vedi AVVERTENZE E PRECAUZIONI , Utilizzare in popolazioni specifiche ].
Effetti sui parametri dello sperma
Avvisare gli uomini che AVODART 0,5 mg può influenzare le caratteristiche dello sperma, ma l'effetto sulla fertilità è sconosciuto [vedi AVVERTENZE E PRECAUZIONI , Utilizzare in popolazioni specifiche ].
Donazione di sangue
Informare gli uomini trattati con AVODART 0,5 mg che non devono donare sangue fino ad almeno 6 mesi dopo l'ultima dose per impedire alle donne in gravidanza di ricevere dutasteride attraverso trasfusioni di sangue [vedere AVVERTENZE E PRECAUZIONI ]. I livelli sierici di dutasteride sono rilevabili da 4 a 6 mesi dopo la fine del trattamento [vedi FARMACOLOGIA CLINICA ].
AVODART è un marchio di proprietà o concesso in licenza al gruppo di società GSK.
Gli altri marchi elencati sono marchi di proprietà o concessi in licenza ai rispettivi proprietari e non sono di proprietà o concessi in licenza al gruppo di società GSK. I produttori di questi marchi non sono affiliati e non promuovono il gruppo di società GSK oi suoi prodotti.
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Cancerogenesi
Uno studio di cancerogenicità di 2 anni è stato condotto su topi B6C3F1 a dosi di 3, 35, 250 e 500 mg/kg/die per i maschi e 3, 35 e 250 mg/kg/die per le femmine; un'aumentata incidenza di adenomi epatocellulari benigni è stata osservata a 250 mg/kg/die (290 volte la MRHD di una dose giornaliera di 0,5 mg) solo nei topi femmine. Due dei 3 principali metaboliti umani sono stati rilevati nei topi. L'esposizione a questi metaboliti nei topi è inferiore rispetto all'uomo o non è nota.
In uno studio di cancerogenicità di 2 anni su ratti Han Wistar, a dosi di 1,5, 7,5 e 53 mg/kg/die nei maschi e 0,8, 6,3 e 15 mg/kg/die nelle femmine, si è verificato un aumento delle cellule di Leydig adenomi nei testicoli a 135 volte la MRHD (53 mg/kg/giorno e oltre). Un'aumentata incidenza di iperplasia delle cellule di Leydig era presente a 52 volte la MRHD (dosi di ratto maschio di 7,5 mg/kg/die e superiori). Una correlazione positiva tra cambiamenti proliferativi nelle cellule di Leydig e un aumento dei livelli di ormone luteinizzante circolante è stata dimostrata con 5 inibitori dell'alfa-reduttasi ed è coerente con un effetto sull'asse ipotalamo-ipofisi-testicolare a seguito dell'inibizione della 5 alfa-reduttasi. A dosi tumorigeniche, i livelli di ormone luteinizzante nei ratti erano aumentati del 167%. In questo studio, i principali metaboliti umani sono stati testati per la cancerogenicità a circa 1-3 volte l'esposizione clinica prevista.
Mutagenesi
La dutasteride è stata testata per la genotossicità in un test di mutagenesi batterica (test di Ames), un test di aberrazione cromosomica in cellule ovariche di criceto cinese e un test del micronucleo nei ratti. I risultati non hanno indicato alcun potenziale genotossico del farmaco originario. Anche due principali metaboliti umani sono risultati negativi nel test di Ames o in un test di Ames abbreviato.
Compromissione della fertilità
Il trattamento di ratti maschi sessualmente maturi con dutasteride a 0,1 volte la MRHD (dosi animali di 0,05 mg/kg/die o superiori fino a 31 settimane) in base alla concentrazione sierica media ha determinato diminuzioni della fertilità dipendenti dalla dose e dal tempo a tutte le dosi ; conta spermatica ridotta (assoluta) nella parte caudale dell'epididimo ma non concentrazione spermatica (a 50 e 500 mg/kg/giorno); peso ridotto dell'epididimo, della prostata e delle vescicole seminali; e alterazioni microscopiche (vacuolizzazione citoplasmatica dell'epitelio tubulare negli epididimi e/o diminuzione del contenuto citoplasmatico dell'epitelio, coerente con una diminuzione dell'attività secretoria nella prostata e nelle vescicole seminali) negli organi riproduttivi a tutte le dosi in assenza di tossicità paterna. Gli effetti sulla fertilità sono stati annullati dalla settimana di recupero 6 a tutte le dosi e la conta degli spermatozoi era normale alla fine di un periodo di recupero di 14 settimane. I cambiamenti microscopici non erano più presenti alla settimana di recupero 14 a 0,1 volte la MRHD e sono stati in parte recuperati nei restanti gruppi di trattamento. Bassi livelli di dutasteride (da 0,6 a 17 ng/mL) sono stati rilevati nel siero di femmine di ratto non trattate accoppiate a maschi trattati (da 10 a 500 mg/kg/giorno per 29-30 settimane) che sono da 16 a 110 volte la MRHD basata su concentrazione sierica media. Non si è verificata alcuna femminilizzazione nella progenie maschile di ratti femmine non trattate accoppiate a ratti maschi trattati anche se nelle femmine di ratto sono stati osservati livelli ematici rilevabili di dutasteride.
In uno studio sulla fertilità in femmine di ratto con dosaggio 4 settimane prima dell'accoppiamento fino all'inizio della gestazione, la somministrazione orale di dutasteride a dosi di 0,05, 2,5, 12,5 e 30 mg/kg/die ha determinato una riduzione delle dimensioni della cucciolata a causa dell'aumento dei riassorbimenti e della femminilizzazione di feti maschi (diminuzione della distanza anogenitale) da 2 a 10 volte la MRHD (dosi animali di 2,5 mg/kg/die o superiori) in base alla concentrazione sierica media, in presenza di tossicità materna (diminuito aumento di peso corporeo). Anche i pesi corporei fetali sono stati ridotti di circa 0,02 volte la MRHD (dose nel ratto di 0,05 mg/kg/giorno o superiore) in base alla concentrazione sierica media, senza alcun livello di effetto, in assenza di tossicità materna.
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
AVODART 0,5 mg è controindicato per l'uso in gravidanza perché può causare danni al feto maschio [vedi CONTROINDICAZIONI ]. AVODART non è indicato per l'uso nelle donne.
AVODART 0,5 mg è un inibitore della 5 alfa-reduttasi che impedisce la conversione del testosterone in diidrotestosterone (DHT), un ormone necessario per il normale sviluppo dei genitali maschili. Le anomalie nei genitali dei feti maschi sono una conseguenza fisiologica prevista dell'inibizione di questa conversione. Questi risultati sono simili alle osservazioni nei neonati maschi con deficit genetico della 5 alfa-reduttasi.
Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo nelle gravidanze clinicamente riconosciute è rispettivamente del 2% e del 4% e del 15% e del 20%.
Negli studi sulla riproduzione animale, la dutasteride ha inibito il normale sviluppo dei genitali esterni nella prole maschile quando somministrata a ratti o conigli durante l'organogenesi a una dose inferiore alla dose massima raccomandata nell'uomo (MRHD) di 0,5 mg al giorno, in assenza di tossicità materna. Nei ratti sono stati osservati 15 volte la MRHD, gravidanza prolungata, diminuzione del peso degli organi riproduttivi e pubertà ritardata nella prole maschile, con livelli di assenza di effetti inferiori alla MRHD di 0,5 mg al giorno. È stato anche osservato un aumento del peso placentare nei conigli, con livelli senza effetti inferiori alla MRHD di 0,5 mg al giorno (vedi Dati ).
Sebbene la dutasteride sia secreta nello sperma umano, la concentrazione del farmaco nella partner femminile umana è circa 100 volte inferiore alle concentrazioni che producono anomalie dei genitali maschili negli studi sugli animali (vedi Dati ). Nelle scimmie somministrate durante l'organogenesi a concentrazioni ematiche paragonabili o superiori a livelli a cui si stima che sia esposta una partner femminile umana, i genitali esterni della prole maschile non sono stati influenzati negativamente. Non si è verificata alcuna femminilizzazione nella progenie maschile di ratti femmine non trattate accoppiate a ratti maschi trattati anche se nelle femmine di ratto sono stati osservati livelli ematici rilevabili di dutasteride [vedi Tossicologia non clinica ].
Dati
Dati umani
La concentrazione spermatica più alta misurata di dutasteride negli uomini trattati era di 14 ng/mL. Sebbene la dutasteride sia rilevata nel liquido seminale, supponendo che una donna di 50 kg venga esposta a 5 ml di sperma e un assorbimento del 100%, la concentrazione ematica di dutasteride prevista per la donna attraverso lo sperma sarebbe di circa 0,0175 ng/ml. Questa concentrazione è circa 100 volte inferiore alle concentrazioni ematiche che producono anomalie dei genitali maschili negli studi sugli animali. La dutasteride è altamente legata alle proteine nello sperma umano (maggiore del 96%), che può ridurre la quantità di dutasteride disponibile per l'assorbimento vaginale.
Dati sugli animali
In uno studio sullo sviluppo embrio-fetale nei ratti, la somministrazione orale di dutasteride a 10 volte meno della MRHD di 0,5 mg al giorno (basata sui livelli ematici medi negli uomini) ha determinato la femminilizzazione dei genitali maschili nel feto (diminuzione della distanza anogenitale a 0,05 mg /kg/giorno, in assenza di un livello senza effetto) in assenza di tossicità materna. Inoltre, si sono verificati sviluppo del capezzolo, ipospadia e ghiandole prepuziali dilatate nei feti di madri trattate a dosi di 2,5 mg/kg/giorno o superiori (circa 15 volte la MRHD). Sono stati osservati un ridotto peso corporeo fetale e un'ossificazione ritardata associata in presenza di tossicità materna (diminuito aumento di peso corporeo) a un'esposizione materna di circa 15 volte la MRHD (dose di 2,5 mg/kg/giorno o superiore). È stato osservato un aumento dei cuccioli nati morti nelle madri trattate con 30 mg/kg/die (circa 111 volte la MRHD), con un livello senza effetti di 12,5 mg/kg/die.
In uno studio sullo sviluppo embrio-fetale di coniglio, dosi 28 volte la MRHD (dosi di 30 mg/kg/giorno o superiori), basate sui livelli ematici medi negli uomini, sono state somministrate per via orale nei giorni di gestazione dal 7 al 29 (durante l'organogenesi e il periodo di sviluppo dei genitali esterni). La valutazione istologica della papilla genitale dei feti ha rivelato prove di femminilizzazione del feto maschio, ossa del cranio fuse e aumento del peso della placenta a tutte le dosi in assenza di tossicità materna. Un secondo studio sullo sviluppo embrio-fetale in conigli somministrati durante la gravidanza (organogenesi e periodo successivo di sviluppo dei genitali esterni [giorni di gestazione da 6 a 29]) a 0,3 volte la MRHD (dosi di 0,05 mg/kg/giorno o superiori, senza no- livello di effetto), ha anche prodotto evidenza di femminilizzazione dei genitali nei feti maschi e aumento del peso placentare a tutte le dosi in assenza di tossicità materna.
In uno studio sullo sviluppo embrio-fetale, scimmie rhesus gravide sono state esposte per via endovenosa durante l'organogenesi (giorni di gestazione da 20 a 100) a un livello ematico di dutasteride paragonabile o superiore all'esposizione stimata alla dutasteride di una partner femminile umana. La dutasteride è stata somministrata nei giorni di gestazione da 20 a 100 (durante l'organogenesi) a dosi di 400, 780, 1.325 o 2.010 ng/giorno (12 scimmie/gruppo). Non è stata osservata alcuna femminilizzazione dei genitali esterni maschili della prole delle scimmie. Alla dose più alta testata sono stati osservati riduzione del peso surrenale fetale, riduzione del peso della prostata fetale e aumento del peso delle ovaie e dei testicoli fetali. Sulla base della concentrazione spermatica più alta misurata di dutasteride negli uomini trattati (14 ng/mL), queste dosi nella scimmia rappresentano fino a 16 volte l'esposizione massima potenziale di una femmina umana di 50 kg a 5 mL di sperma al giorno da una dutasteride- maschio trattato, assumendo un assorbimento del 100%. I livelli di dose (su base ng/kg) somministrati alle scimmie in questo studio sono da 32 a 186 volte la dose nominale (ng/kg) a cui una femmina sarebbe potenzialmente esposta attraverso lo sperma. Non è noto se i conigli o le scimmie rhesus producano uno dei principali metaboliti umani.
In uno studio sullo sviluppo orale pre e postnatale nei ratti, è stata osservata la femminilizzazione dei genitali maschili. È stata osservata una riduzione della distanza anogenitale pari a 0,05 volte la MRHD e superiore (0,05 mg/kg/giorno e oltre), con la mancanza di un livello senza effetti, basato sui livelli ematici medi negli uomini come stima dell'AUC. L'ipospadia e lo sviluppo del capezzolo sono stati osservati a 2,5 mg/kg/giorno o superiore (14 volte la MRHD o superiore, con un livello senza effetti a 0,05 mg/kg/giorno). Dosi di 2,5 mg/kg/die e superiori hanno anche determinato una gestazione prolungata nelle femmine genitori, un aumento del tempo alla separazione balano-prepuziale nella prole maschile, una diminuzione del tempo alla pervietà vaginale per la prole femminile e una diminuzione della prostata e pesi delle vescicole seminali nella prole maschile. Sono stati osservati un aumento dei nati morti e una diminuzione della vitalità neonatale nella prole a 30 mg/kg/die (102 volte la MRHD in presenza di tossicità materna [diminuzione del peso corporeo]).
Allattamento
Riepilogo dei rischi
AVODART non è indicato per l'uso nelle donne. Non sono disponibili informazioni sulla presenza di dutasteride nel latte materno, gli effetti sul bambino allattato al seno o gli effetti sulla produzione di latte.
Femmine E Maschi Di Potenziale Riproduttivo
Infertilità
Maschi
Gli effetti di dutasteride 0,5 mg/die sulle caratteristiche dello sperma sono stati valutati in volontari normali di età compresa tra 18 e 52 anni (n = 27 dutasteride, n = 23 placebo) durante 52 settimane di trattamento e 24 settimane di follow-up post-trattamento. A 52 settimane, le riduzioni percentuali medie rispetto al basale della conta spermatica totale, del volume dello sperma e della motilità degli spermatozoi erano rispettivamente del 23%, 26% e 18% nel gruppo dutasteride, quando aggiustato per le variazioni rispetto al basale nel gruppo placebo. La concentrazione spermatica e la morfologia degli spermatozoi non sono state influenzate. Dopo 24 settimane di follow-up, la variazione percentuale media della conta spermatica totale nel gruppo dutasteride è rimasta inferiore del 23% rispetto al basale. Mentre i valori medi per tutti i parametri dello sperma in tutti i punti temporali sono rimasti entro i range normali e non hanno soddisfatto i criteri predefiniti per un cambiamento clinicamente significativo (30%), 2 soggetti nel gruppo dutasteride hanno avuto diminuzioni della conta spermatica superiori al 90% rispetto al basale a 52 settimane, con recupero parziale al follow-up di 24 settimane. Il significato clinico dell'effetto della dutasteride sulle caratteristiche dello sperma per la fertilità di un singolo paziente non è noto [vedi AVVERTENZE E PRECAUZIONI ].
Uso pediatrico
AVODART 0,5 mg non è indicato per l'uso nei pazienti pediatrici. La sicurezza e l'efficacia nei pazienti pediatrici non sono state stabilite.
Uso geriatrico
Dei 2.167 soggetti di sesso maschile trattati con AVODART 0,5 mg in 3 studi clinici, il 60% aveva un'età pari o superiore a 65 anni e il 15% aveva un'età pari o superiore a 75 anni. Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra questi soggetti e i soggetti più giovani. Altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e quelli più giovani, ma non può essere esclusa una maggiore sensibilità di alcuni individui più anziani [vedi FARMACOLOGIA CLINICA ].
Insufficienza renale
Non è necessario alcun aggiustamento della dose per AVODART 0,5 mg in pazienti con insufficienza renale [vedere FARMACOLOGIA CLINICA ].
Insufficienza epatica
L'effetto dell'insufficienza epatica sulla farmacocinetica della dutasteride non è stato studiato. Poiché la dutasteride è ampiamente metabolizzata, l'esposizione potrebbe essere maggiore nei pazienti con insufficienza epatica. Tuttavia, in uno studio clinico in cui 60 soggetti hanno ricevuto 5 mg (10 volte la dose terapeutica) al giorno per 24 settimane, non sono stati osservati eventi avversi aggiuntivi rispetto a quelli osservati alla dose terapeutica di 0,5 mg [vedere FARMACOLOGIA CLINICA ].
OVERDOSE
Negli studi su volontari, sono state somministrate dosi singole di dutasteride fino a 40 mg (80 volte la dose terapeutica) per 7 giorni senza significativi problemi di sicurezza. In uno studio clinico, dosi giornaliere di 5 mg (10 volte la dose terapeutica) sono state somministrate a 60 soggetti per 6 mesi senza effetti avversi aggiuntivi rispetto a quelli osservati a dosi terapeutiche di 0,5 mg.
Non esiste un antidoto specifico per dutasteride. Pertanto, in caso di sospetto sovradosaggio, deve essere somministrato un trattamento sintomatico e di supporto appropriato, tenendo in considerazione la lunga emivita della dutasteride.
CONTROINDICAZIONI
AVODART 0,5 mg è controindicato per l'uso in:

- Gravidanza. L'uso di dutasteride è controindicato nelle donne in gravidanza. Negli studi sulla riproduzione animale e sulla tossicità dello sviluppo, dutasteride ha inibito lo sviluppo dei genitali esterni del feto maschile. Pertanto, AVODART 0,5 mg può causare danni al feto se somministrato a una donna incinta [vedi AVVERTENZE E PRECAUZIONI , Utilizzare in popolazioni specifiche ].
- Pazienti con ipersensibilità clinicamente significativa precedentemente dimostrata (p. es., reazioni cutanee gravi, angioedema) all'AVODART o ad altri inibitori della 5 alfa-reduttasi [vedere REAZIONI AVVERSE ].
FARMACOLOGIA CLINICA
Meccanismo di azione
La dutasteride inibisce la conversione del testosterone in DHT. Il DHT è l'androgeno principalmente responsabile dello sviluppo iniziale e del successivo ingrossamento della ghiandola prostatica. Il testosterone viene convertito in DHT dall'enzima 5 alfa-reduttasi, che esiste come 2 isoforme, tipo 1 e tipo 2. L'isoenzima di tipo 2 è attivo principalmente nei tessuti riproduttivi, mentre l'isoenzima di tipo 1 è anche responsabile della conversione del testosterone nel pelle e fegato.
La dutasteride è un inibitore competitivo e specifico degli isoenzimi dell'alfa-reduttasi di tipo 1 e di tipo 2 5, con i quali forma un complesso enzimatico stabile. La dissociazione da questo complesso è stata valutata in condizioni in vitro e in vivo ed è estremamente lenta. La dutasteride non si lega al recettore degli androgeni umani.
Farmacodinamica
Effetto su 5 alfa-diidrotestosterone e testosterone
L'effetto massimo delle dosi giornaliere di dutasteride sulla riduzione del DHT dipende dalla dose e si osserva entro 1 o 2 settimane. Dopo 1 e 2 settimane di somministrazione giornaliera di dutasteride 0,5 mg, le concentrazioni sieriche mediane di DHT sono state ridotte rispettivamente dell'85% e del 90%. Nei pazienti con IPB trattati con dutasteride 0,5 mg/die per 4 anni, la diminuzione mediana del DHT sierico è stata del 94% a 1 anno, del 93% a 2 anni e del 95% sia a 3 che a 4 anni. L'aumento mediano del testosterone sierico è stato del 19% sia a 1 che a 2 anni, del 26% a 3 anni e del 22% a 4 anni, ma i livelli medi e mediani sono rimasti all'interno dell'intervallo fisiologico.
Nei pazienti con IPB trattati con 5 mg/die di dutasteride o placebo fino a 12 settimane prima della resezione transuretrale della prostata, le concentrazioni medie di DHT nel tessuto prostatico erano significativamente inferiori nel gruppo dutasteride rispetto al placebo (784 e 5.793 pg/g , rispettivamente, P
Anche i maschi adulti con deficit di alfa-reduttasi di tipo 2 5 geneticamente ereditato hanno livelli di DHT ridotti. Questi maschi carenti di 5 alfa-reduttasi hanno una piccola ghiandola prostatica per tutta la vita e non sviluppano BPH. Fatta eccezione per i difetti urogenitali associati presenti alla nascita, in questi soggetti non sono state osservate altre anomalie cliniche correlate al deficit di 5 alfa-reduttasi.
Effetti su altri ormoni
In volontari sani, 52 settimane di trattamento con dutasteride 0,5 mg/die (n = 26) non hanno determinato alcun cambiamento clinicamente significativo rispetto al placebo (n = 23) in globulina legante gli ormoni sessuali, estradiolo, ormone luteinizzante, ormone follicolo-stimolante, tiroxina (T4 libero) e deidroepiandrosterone. Sono stati osservati aumenti medi aggiustati al basale statisticamente significativi rispetto al placebo per il testosterone totale a 8 settimane (97,1 ng/dL, P
Altri effetti
Il pannello lipidico plasmatico e la densità minerale ossea sono stati valutati dopo 52 settimane di dutasteride 0,5 mg una volta al giorno in volontari sani. Non vi è stato alcun cambiamento nella densità minerale ossea misurata mediante assorbimetria a raggi X a doppia energia rispetto al placebo o al basale. Inoltre, il profilo lipidico plasmatico (cioè, colesterolo totale, lipoproteine a bassa densità, lipoproteine ad alta densità, trigliceridi) non è stato influenzato dalla dutasteride. Non sono stati osservati cambiamenti clinicamente significativi nelle risposte dell'ormone surrenale alla stimolazione dell'ormone adrenocorticotropo (ACTH) in un sottogruppo di popolazione (n = 13) dello studio su volontari sani di 1 anno.
Farmacocinetica
Assorbimento
Dopo la somministrazione di una singola dose da 0,5 mg di una capsula di gelatina molle, il tempo per raggiungere il picco delle concentrazioni sieriche (Tmax) di dutasteride si verifica entro 2-3 ore. La biodisponibilità assoluta in 5 soggetti sani è di circa il 60% (intervallo: dal 40% al 94%). Quando il farmaco viene somministrato con il cibo, le concentrazioni sieriche massime sono state ridotte dal 10% al 15%. Questa riduzione non ha alcun significato clinico.
Distribuzione
I dati di farmacocinetica dopo dosi orali singole e ripetute mostrano che dutasteride ha un ampio volume di distribuzione (da 300 a 500 l). La dutasteride è fortemente legata all'albumina plasmatica (99,0%) e alla glicoproteina acida alfa-1 (96,6%).
In uno studio su soggetti sani (n = 26) trattati con dutasteride 0,5 mg/die per 12 mesi, le concentrazioni di dutasteride nello sperma erano in media di 3,4 ng/mL (intervallo: da 0,4 a 14 ng/mL) a 12 mesi e, similmente al siero, hanno raggiunto una stabilità -concentrazioni statali a 6 mesi. In media, a 12 mesi l'11,5% delle concentrazioni sieriche di dutasteride si ripartiva nello sperma.
Metabolismo ed eliminazione
La dutasteride è ampiamente metabolizzata nell'uomo. Studi in vitro hanno dimostrato che dutasteride viene metabolizzata dagli isoenzimi CYP3A4 e CYP3A5. Entrambi questi isoenzimi hanno prodotto i metaboliti 4'-idrossidutasteride, 6-idrossidutasteride e 6,4'-diidrossidutasteride. Inoltre, il metabolita 15-idrossidutasteride è stato formato dal CYP3A4. La dutasteride non viene metabolizzata in vitro dagli isoenzimi del citocromo P450 umano CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 e CYP2E1. Nel siero umano dopo la somministrazione allo stato stazionario, dutasteride immodificato, 3 metaboliti principali (4'-idrossidutasteride, 1,2-diidrodutasteride e 6-idrossidutasteride) e 2 metaboliti minori (6,4'-diidrossidutasteride e 15 -idrossidutasteride), valutata mediante risposta spettrometrica di massa. La stereochimica assoluta delle aggiunte di idrossile nelle posizioni 6 e 15 non è nota. In vitro, i metaboliti 4'-idrossidutasteride e 1,2-diidrodutasteride sono molto meno potenti della dutasteride contro entrambe le isoforme della 5 alfa-reduttasi umana. L'attività della 6β-idrossidutasteride è paragonabile a quella della dutasteride.
La dutasteride ei suoi metaboliti sono stati escreti principalmente nelle feci. Come percentuale della dose, c'era circa il 5% di dutasteride immodificato (da ~1% a ~15%) e il 40% come metaboliti correlati alla dutasteride (da ~2% a ~90%). Solo tracce di duasteride immodificata sono state trovate nelle urine (
L'emivita terminale di eliminazione della dutasteride è di circa 5 settimane allo stato stazionario. La concentrazione media di dutasteride sierica allo stato stazionario era di 40 ng/mL dopo 0,5 mg/die per 1 anno. Dopo la somministrazione giornaliera, le concentrazioni sieriche di dutasteride raggiungono il 65% della concentrazione allo stato stazionario dopo 1 mese e circa il 90% dopo 3 mesi. A causa della lunga emivita della dutasteride, le concentrazioni sieriche rimangono rilevabili (maggiori di 0,1 ng/mL) fino a 4-6 mesi dopo l'interruzione del trattamento.
Popolazioni specifiche
Pazienti Pediatrici
La farmacocinetica della dutasteride non è stata studiata in soggetti di età inferiore ai 18 anni.
Pazienti geriatrici
Non è necessario alcun aggiustamento della dose negli anziani. La farmacocinetica e la farmacodinamica della dutasteride sono state valutate in 36 soggetti maschi sani di età compresa tra 24 e 87 anni dopo la somministrazione di una singola dose di 5 mg di dutasteride. In questo studio a dose singola, l'emivita della dutasteride è aumentata con l'età (circa 170 ore negli uomini di età compresa tra 20 e 49 anni, circa 260 ore negli uomini di età compresa tra 50 e 69 anni e circa 300 ore negli uomini di età superiore a 70 anni). Dei 2.167 uomini trattati con dutasteride nei 3 studi cardine, il 60% aveva 65 anni e più e il 15% aveva 75 anni e più. Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra questi pazienti e i pazienti più giovani.
Pazienti maschi e femmine
AVODART è controindicato in gravidanza e non è indicato per l'uso nelle donne [vedi CONTROINDICAZIONI , AVVERTENZE E PRECAUZIONI ]. La farmacocinetica della dutasteride nelle donne non è stata studiata.
Gruppi razziali ed etnici
L'effetto della razza sulla farmacocinetica della dutasteride non è stato studiato.
Pazienti con insufficienza renale
L'effetto dell'insufficienza renale sulla farmacocinetica di dutasteride non è stato studiato. Tuttavia, meno dello 0,1% di una dose allo stato stazionario di 0,5 mg di dutasteride viene ritrovata nelle urine umane, quindi non è previsto alcun aggiustamento del dosaggio per i pazienti con insufficienza renale.
Pazienti con insufficienza epatica
L'effetto dell'insufficienza epatica sulla farmacocinetica della dutasteride non è stato studiato. Poiché la dutasteride è ampiamente metabolizzata, l'esposizione potrebbe essere maggiore nei pazienti con insufficienza epatica.
Studi sull'interazione tra farmaci
Inibitori del citocromo P450
Non sono stati condotti studi clinici di interazione farmacologica per valutare l'impatto degli inibitori dell'enzima CYP3A sulla farmacocinetica della dutasteride. Tuttavia, sulla base dei dati in vitro, le concentrazioni ematiche di dutasteride possono aumentare in presenza di inibitori del CYP3A4/5 come ritonavir, ketoconazolo, verapamil, diltiazem, cimetidina, troleandomicina e ciprofloxacina.
La dutasteride non inibisce il metabolismo in vitro dei substrati modello per i principali isoenzimi del citocromo P450 umano (CYP1A2, CYP2C9, CYP2C19, CYP2D6 e CYP3A4) a una concentrazione di 1.000 ng/mL, 25 volte maggiore delle concentrazioni sieriche allo stato stazionario nell'uomo .
Antagonisti alfa-adrenergici
In uno studio crossover a sequenza singola su volontari sani, la somministrazione di tamsulosina o terazosina in combinazione con AVODART non ha avuto effetti sulla farmacocinetica allo stato stazionario di nessuno dei due antagonisti alfa-adrenergici. Sebbene l'effetto della somministrazione di tamsulosina o terazosina sui parametri farmacocinetici della dutasteride non sia stato valutato, la variazione percentuale delle concentrazioni di DHT è risultata simile per AVODART 0,5 mg da solo rispetto al trattamento di associazione.
Antagonisti del canale del calcio
In un'analisi di farmacocinetica di popolazione, è stata osservata una diminuzione della clearance di dutasteride quando co-somministrata con gli inibitori del CYP3A4 verapamil (-37%, n = 6) e diltiazem (-44%, n = 5). Al contrario, non è stata osservata alcuna diminuzione della clearance quando l'amlodipina, un altro calcio antagonista che non è un inibitore del CYP3A4, è stata co-somministrata con dutasteride (+7%, n = 4).
La diminuzione della clearance e il conseguente aumento dell'esposizione alla dutasteride in presenza di verapamil e diltiazem non sono considerati clinicamente significativi. Non è raccomandato alcun aggiustamento della dose.
colestiramina
La somministrazione di una singola dose da 5 mg di AVODART 0,5 mg seguita 1 ora dopo da 12 g di colestiramina non ha influenzato la biodisponibilità relativa di dutasteride in 12 volontari normali.
Digossina
In uno studio su 20 volontari sani, AVODART 0,5 mg non ha alterato la farmacocinetica allo stato stazionario della digossina quando somministrato in concomitanza a una dose di 0,5 mg/die per 3 settimane.
Warfarin
In uno studio condotto su 23 volontari sani, 3 settimane di trattamento con AVODART 0,5 mg/die non hanno alterato la farmacocinetica allo stato stazionario degli isomeri S- o R-warfarin né l'effetto del warfarin sul tempo di protrombina quando somministrato con warfarin.
Altre terapie concomitanti
Sebbene non siano stati condotti studi di interazione specifica con altri composti, circa il 90% dei soggetti nei 3 studi randomizzati, in doppio cieco, controllati con placebo sulla sicurezza e sull'efficacia che hanno ricevuto AVODART stavano assumendo altri farmaci contemporaneamente. Nessuna interazione avversa clinicamente significativa può essere attribuita alla combinazione di AVODART e terapia concomitante quando AVODART è stato somministrato in concomitanza con anti-iperlipidemici, inibitori dell'enzima di conversione dell'angiotensina (ACE), agenti beta-bloccanti adrenergici, calcio-antagonisti, corticosteroidi, diuretici, anti-infiammatori non steroidei -farmaci infiammatori (FANS), inibitori della fosfodiesterasi di tipo V e antibiotici chinolonici.
Tossicologia animale e/o farmacologia
Studi sulla tossicologia del sistema nervoso centrale
Nei ratti e nei cani, la somministrazione orale ripetuta di dutasteride ha portato alcuni animali a mostrare segni di tossicità non specifica, reversibile, mediata a livello centrale senza alterazioni istopatologiche associate a esposizioni rispettivamente di 425 e 315 volte l'esposizione clinica prevista (del farmaco originario). .
Assorbimento cutaneo del coniglio
In uno studio di farmacocinetica cutanea nel coniglio, l'assorbimento dermico di dutasteride in CAPMUL (gliceril oleato) nei conigli ha determinato concentrazioni sieriche comprese tra 2,7 e 40,5 mcg/h/mL per dosi rispettivamente da 1 a 20 mg/mL, o dal 56% al 100% di dutasteride applicato da assorbire in condizioni occluse e prolungate. Le capsule di gelatina molle AVODART somministrate per via orale contengono 0,5 mg di dutasteride disciolto in una miscela di mono-digliceridi di acido caprilico/caprico e idrossitoluene butilato. La dutasteride in acqua è stata assorbita minimamente nei conigli (2.000 mg/kg).
Studi clinici
Monoterapia
AVODART 0,5 mg/die (n = 2.167) o placebo (n = 2.158) è stato valutato in soggetti di sesso maschile con IPB in tre studi multicentrici di 2 anni, controllati con placebo, in doppio cieco, ciascuno con estensioni di 2 anni in aperto ( n = 2.340). Più del 90% della popolazione di prova era bianca. I soggetti avevano almeno 50 anni di età con un PSA sierico ≥1,5 ng/mL e
Effetto sui punteggi dei sintomi
sintomi sono stati quantificati utilizzando l'AUA-SI, un questionario che valuta i sintomi urinari (svuotamento incompleto, frequenza, intermittenza, urgenza, flusso debole, sforzo e nicturia) valutando su una scala da 0 a 5 per un punteggio totale possibile di 35, con punteggi dei sintomi totali numerici più elevati che rappresentano una maggiore gravità dei sintomi. Il punteggio AUA-SI basale nei 3 studi era di circa 17 unità in entrambi i gruppi di trattamento.
soggetti trattati con dutasteride hanno ottenuto un miglioramento statisticamente significativo dei sintomi rispetto al placebo entro il mese 3 in 1 studio ed entro il mese 12 negli altri 2 studi cardine. Al mese 12, la diminuzione media rispetto al basale dei punteggi totali dei sintomi AUA-SI nei 3 studi aggregati era -3,3 unità per dutasteride e -2,0 unità per placebo con una differenza media tra i 2 gruppi di trattamento di -1,3 (intervallo: -1,1 a -1,5 unità in ciascuna delle 3 prove, P
Questi studi sono stati progettati in modo prospettico per valutare gli effetti sui sintomi in base alle dimensioni della prostata al basale. Negli uomini con volumi della prostata ≥40 cc, la diminuzione media è stata di -3,8 unità per dutasteride e -1,6 unità per il placebo, con una differenza media tra i 2 gruppi di trattamento di -2,2 al mese 24. Negli uomini con volumi della prostata
Figura 1: Variazione del punteggio AUA-SI rispetto al basale (prove randomizzate, in doppio cieco, controllate con placebo raggruppate)
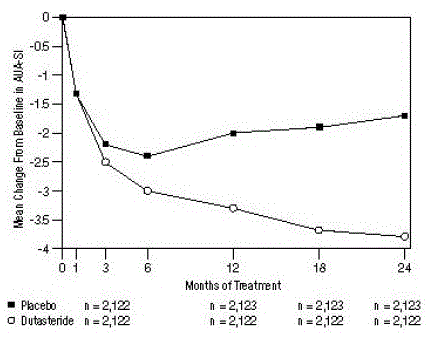
un punteggio AUA-SI varia da 0 a 35.
Effetto sulla ritenzione urinaria acuta e sulla necessità di un intervento chirurgico correlato all'IPB
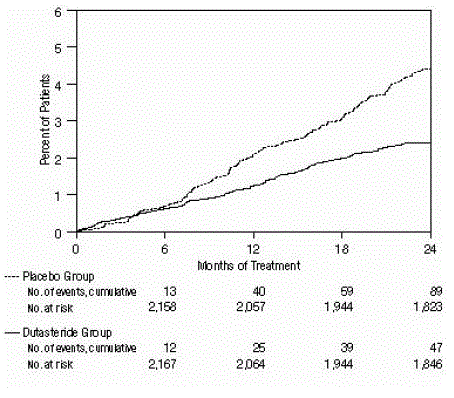
L'efficacia è stata valutata anche dopo 2 anni di trattamento dall'incidenza di AUR che richiedeva cateterizzazione e intervento chirurgico urologico correlato all'IPB. Rispetto al placebo, AVODART è stato associato a un'incidenza statisticamente significativa di AUR (1,8% per AVODART contro 4,2% per placebo, P
Figura 2: Percentuale di soggetti che sviluppano ritenzione urinaria acuta in un periodo di 24 mesi (prove randomizzate, in doppio cieco, controllate con placebo raggruppate)
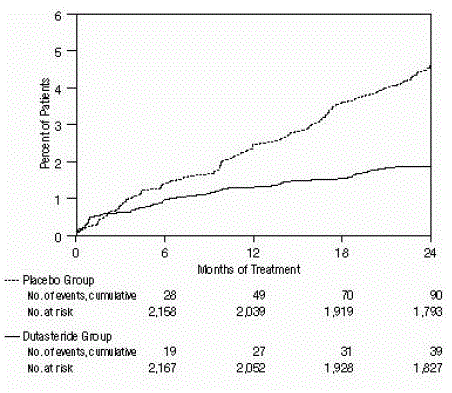
Figura 3: Percentuale di soggetti sottoposti a intervento chirurgico per iperplasia prostatica benigna in un periodo di 24 mesi (prove randomizzate, in doppio cieco, controllate con placebo raggruppate)
Effetto sul volume della prostata
Per l'ingresso nella prova era richiesto un volume della prostata di almeno 30 cc misurato mediante ecografia transrettale. Il volume medio della prostata all'inizio della prova era di circa 54 cc.
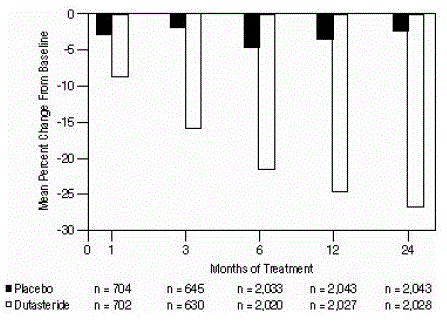
Differenze statisticamente significative (AVODART 0,5 mg rispetto a placebo) sono state rilevate alla prima misurazione del volume prostatico post-trattamento in ogni studio (mese 1, mese 3 o mese 6) e sono proseguite fino al mese 24. Al mese 12, la variazione percentuale media di il volume della prostata nei 3 studi aggregati era -24,7% per dutasteride e -3,4% per placebo; la differenza media (dutasteride meno placebo) era -21,3% (intervallo: da -21,0% a -21,6% in ciascuno dei 3 studi, P
Figura 4: Variazione percentuale del volume della prostata rispetto al basale (prove randomizzate, in doppio cieco, controllate con placebo raggruppate)
Effetto sulla portata massima di urina
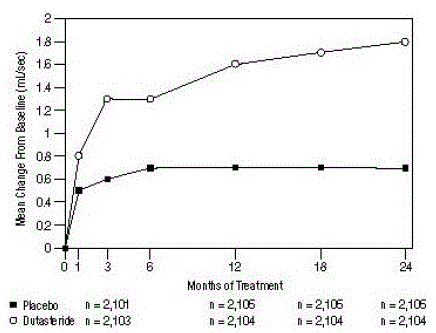
Per l'ingresso nello studio era richiesta una velocità di flusso urinario di picco medio (Qmax) di ≤15 ml/sec. Il Qmax era di circa 10 ml/sec al basale nei 3 studi cardine.
Le differenze tra i 2 gruppi erano statisticamente significative dal basale al mese 3 in tutti e 3 gli studi e sono state mantenute fino al mese 12. Al mese 12, l'aumento medio del Qmax nei 3 studi aggregati era di 1,6 ml/sec per AVODART 0,5 mg e 0,7 ml /sec per placebo; la differenza media (dutasteride meno placebo) era di 0,8 ml/sec (intervallo: da 0,7 a 1,0 ml/sec in ciascuno dei 3 studi, p
Figura 5: Variazione Qmax rispetto al basale (prove randomizzate, in doppio cieco, controllate con placebo raggruppate)
Riassunto delle sperimentazioni cliniche
I dati di 3 studi di efficacia ampi e ben controllati dimostrano che il trattamento con AVODART (0,5 mg una volta al giorno) riduce il rischio di intervento chirurgico correlato sia all'AUR che all'IPB rispetto al placebo, migliora i sintomi correlati all'IPB, diminuisce il volume della prostata e aumenta il massimo portate urinarie. Questi dati suggeriscono che AVODART 0,5 mg arresta il processo patologico dell'IPB negli uomini con ingrossamento della prostata.
Combinazione con terapia alfa-bloccante (CombAT)
L'efficacia della terapia di combinazione (AVODART 0,5 mg/die più tamsulosina 0,4 mg/die, n = 1.610) è stata confrontata con AVODART 0,5 mg da solo (n = 1.623) o tamsulosina da sola (n = 1.611) in un multicentrico di 4 anni, randomizzato , processo in doppio cieco. I criteri di accesso allo studio erano simili agli studi di efficacia in monoterapia in doppio cieco, controllati con placebo descritti nella Sezione 14.1. L'88% (88%) della popolazione di prova arruolata era bianca. Circa il 52% dei soggetti ha avuto una precedente esposizione al trattamento con antagonisti della 5 alfa-reduttasi, inibitore o alfa-adrenergico. Dei 4.844 soggetti assegnati in modo casuale a ricevere il trattamento, il 69% dei soggetti nel gruppo di combinazione, il 67% nel gruppo che ha ricevuto AVODART 0,5 mg e il 61% nel gruppo tamsulosina ha completato 4 anni di trattamento in doppio cieco.
Effetto sul punteggio dei sintomi
sintomi sono stati quantificati utilizzando le prime 7 domande dell'International Prostate Symptom Score (IPSS) (identico all'AUA-SI). Il punteggio di base era di circa 16,4 unità per ciascun gruppo di trattamento. La terapia di combinazione è risultata statisticamente superiore a ciascuno dei trattamenti in monoterapia nella diminuzione del punteggio dei sintomi al mese 24, il punto temporale primario per questo endpoint. Al mese 24 le variazioni medie rispetto al basale (±DS) nei punteggi totali dei sintomi IPSS erano -6,2 (±7,14) per la combinazione, -4,9 (±6,81) per AVODART e -4,3 (±7,01) per tamsulosina, con una differenza media tra combinazione e AVODART 0,5 mg di -1,3 unità (P
Figura 6: Variazione del punteggio internazionale dei sintomi della prostata rispetto al basale in un periodo di 48 mesi (prova randomizzata, in doppio cieco, a gruppi paralleli [prova CombAT])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/09ebd4bcd757d02cb7957567c87fde03.jpg)
Effetto sulla ritenzione urinaria acuta o sulla necessità di un intervento chirurgico correlato all'IPB
Dopo 4 anni di trattamento, la terapia di combinazione con AVODART 0,5 mg e tamsulosina non ha fornito benefici rispetto alla monoterapia con AVODART nel ridurre l'incidenza di AUR o chirurgia correlata all'IPB.
Effetto sulla portata massima di urina
Il Qmax basale era di circa 10,7 ml/sec per ciascun gruppo di trattamento. La terapia di combinazione è risultata statisticamente superiore a ciascuno dei trattamenti in monoterapia nell'aumento del Qmax al mese 24, il punto temporale primario per questo endpoint. Al mese 24, gli aumenti medi rispetto al basale (±DS) di Qmax erano 2,4 (±5,26) ml/sec per la combinazione, 1,9 (±5,10) ml/sec per AVODART 0,5 mg e 0,9 (±4,57) ml/sec per tamsulosina, con una differenza media tra combinazione e AVODART di 0,5 ml/sec (P = 0,003; [IC 95%: 0,17, 0,84]) e tra combinazione e tamsulosina di 1,5 ml/sec (P
L'ulteriore miglioramento del Qmax della terapia di associazione rispetto alla monoterapia con AVODART 0,5 mg non era più statisticamente significativo al mese 48.
Figura 7: Variazione Qmax dal basale su un periodo di 24 mesi (prova randomizzata, in doppio cieco, a gruppi paralleli [prova CombAT])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/13e87aa1083f65c9805c76840dc6feea.jpg)
Effetto sul volume della prostata
Il volume medio della prostata all'inizio della prova era di circa 55 cc. Al mese 24, il punto temporale primario per questo endpoint, le variazioni percentuali medie rispetto al basale (±DS) del volume della prostata erano -26,9% (±22,57) per la terapia di combinazione, -28,0% (±24,88) per AVODART 0,5 mg e 0% (±31,14) per tamsulosina, con una differenza media tra combinazione e AVODART 0,5 mg dell'1,1% (P = NS; [IC 95%: -0,6, 2,8]) e tra combinazione e tamsulosina di -26,9% (P
INFORMAZIONI PER IL PAZIENTE
AVODART (av o dart) (dutasteride) capsule
AVODART 0,5 mg è destinato esclusivamente agli uomini.
Leggi queste informazioni per il paziente prima di iniziare a prendere AVODART 0,5 mg e ogni volta che ricevi una ricarica. Potrebbero esserci nuove informazioni. Queste informazioni non sostituiscono il colloquio con il tuo medico in merito alle tue condizioni mediche o al tuo trattamento.
Che cos'è AVODART 0,5 mg?
AVODART 0,5 mg è un medicinale soggetto a prescrizione che contiene dutasteride. AVODART 0,5 mg è usato per trattare i sintomi dell'iperplasia prostatica benigna (BPH) negli uomini con una prostata ingrossata per:
- migliorare i sintomi,
- ridurre il rischio di ritenzione urinaria acuta (un blocco completo del flusso urinario),
- ridurre il rischio della necessità di un intervento chirurgico correlato all'IPB.
Chi NON dovrebbe assumere AVODART?
Non prenda AVODART se lei è:
- incinta o potrebbe rimanere incinta. AVODART 0,5 mg può danneggiare il feto. Le donne in gravidanza non devono toccare le capsule di AVODART. Se una donna incinta di un bambino maschio riceve abbastanza AVODART 0,5 mg nel suo corpo ingoiando o toccando AVODART, il bambino maschio può nascere con organi sessuali che non sono normali. Se una donna incinta o una donna in età fertile entra in contatto con le capsule di AVODART 0,5 mg che perdono, l'area di contatto deve essere lavata immediatamente con acqua e sapone.
- un bambino o un adolescente.
- allergico alla dutasteride o ad uno qualsiasi degli eccipienti di AVODART. Vedere la fine di questo foglio illustrativo per un elenco completo degli ingredienti di AVODART.
- allergico ad altri inibitori della 5 alfa-reduttasi, ad esempio compresse PROSCAR (finasteride) ®.
Cosa devo dire al mio medico prima di prendere AVODART 0,5 mg?
Prima di prendere AVODART 0,5 mg, informi il medico se:
- ha problemi al fegato
Informa il tuo medico di tutti i medicinali che prendi, inclusi medicinali soggetti a prescrizione e senza prescrizione medica, vitamine e integratori a base di erbe. AVODART e altri medicinali possono influenzarsi a vicenda, causando effetti collaterali. AVODART 0,5 mg può influire sul modo in cui agiscono altri medicinali e altri medicinali possono influire sul modo in cui AVODART 0,5 mg agisce.
Conosci le medicine che prendi. Tienine un elenco da mostrare al tuo medico e al farmacista quando ricevi un nuovo medicinale.
Come devo prendere AVODART?
- Assumere 1 capsula di AVODART una volta al giorno.
- Ingoiare AVODART 0,5 mg capsule intere. Non frantumare, masticare o aprire le capsule di AVODART 0,5 mg perché il contenuto della capsula può irritare le labbra, la bocca o la gola.
- Puoi prendere AVODART 0,5 mg con o senza cibo.
- Se dimentica una dose, può prenderla più tardi quel giorno. Non recuperi la dose dimenticata assumendo 2 dosi il giorno successivo.
Cosa dovrei evitare durante l'assunzione di AVODART 0,5 mg?
- Non deve donare sangue durante l'assunzione di AVODART o per 6 mesi dopo aver interrotto AVODART. Questo è importante per impedire alle donne in gravidanza di ricevere AVODART attraverso trasfusioni di sangue.
Quali sono i possibili effetti collaterali di AVODART?
AVODART può causare gravi effetti collaterali, tra cui:
- Reazioni allergiche rare e gravi, tra cui:
- gonfiore del viso, della lingua o della gola
- reazioni cutanee gravi, come desquamazione della pelle
Chiedi immediatamente assistenza medica se hai queste gravi reazioni allergiche.
- Maggiore probabilità di una forma più grave di cancro alla prostata.
Gli effetti collaterali più comuni di AVODART includono:
- difficoltà ad avere o mantenere un'erezione (impotenza)*
- una diminuzione del desiderio sessuale (libido)*
- problemi di eiaculazione*
- seno ingrossato o doloroso. Se noti noduli al seno o secrezioni dai capezzoli, dovresti parlare con il tuo medico.
*Alcuni di questi eventi possono continuare dopo aver interrotto l'assunzione di AVODART.
Umore depresso è stato riportato in pazienti che hanno ricevuto AVODART.
È stato dimostrato che AVODART 0,5 mg riduce il numero di spermatozoi, il volume dello sperma e il movimento degli spermatozoi. Tuttavia, l'effetto di AVODART 0,5 mg sulla fertilità maschile non è noto.
Test dell'antigene prostatico specifico (PSA): Il tuo medico potrebbe controllarti per altri problemi alla prostata, incluso il cancro alla prostata prima di iniziare e durante l'assunzione di AVODART. A volte viene utilizzato un esame del sangue chiamato PSA (antigene prostatico specifico) per vedere se potresti avere il cancro alla prostata. AVODART ridurrà la quantità di PSA misurata nel sangue. Il tuo medico è a conoscenza di questo effetto e può ancora usare il PSA per vedere se potresti avere il cancro alla prostata. Gli aumenti dei livelli di PSA durante il trattamento con AVODART (anche se i livelli di PSA sono nell'intervallo normale) devono essere valutati dal medico.
Informa il tuo medico se hai qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di AVODART. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
Come devo conservare AVODART 0,5 mg?
- Conservare le capsule di AVODART 0,5 mg a temperatura ambiente (da 59°F a 86°F o da 15°C a 30°C).
- Le capsule di AVODART 0,5 mg possono deformarsi e/o scolorire se conservate a temperature elevate.
- Non usi AVODART 0,5 mg se le capsule sono deformate, scolorite o con perdite.
- Getti via in sicurezza i medicinali che non sono più necessari.
Tenere AVODART 0,5 mg e tutti i medicinali fuori dalla portata dei bambini.
Talvolta i medicinali vengono prescritti per scopi diversi da quelli elencati in un foglio illustrativo per il paziente. Non utilizzare AVODART 0,5 mg per una condizione per la quale non è stato prescritto. Non somministrare AVODART ad altre persone, anche se hanno i tuoi stessi sintomi. Potrebbe danneggiarli.
Questo opuscolo informativo per il paziente riassume le informazioni più importanti su AVODART. Se desideri maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo farmacista o operatore sanitario informazioni su AVODART 0,5 mg scritto per gli operatori sanitari.
Per ulteriori informazioni, visitare www.AVODART.com o chiamare il numero 1-888-825-5249.
Quali sono gli ingredienti di AVODART 0,5 mg?
Principio attivo: dutasteride.
Ingredienti inattivi : idrossitoluene butilato, ossido ferrico (giallo), gelatina (da fonti bovine certificate esenti da BSE), glicerina, mono-digliceridi dell'acido caprilico/caprico, biossido di titanio e inchiostro rosso commestibile.
Come funziona AVODART?
La crescita della prostata è causata da un ormone nel sangue chiamato diidrotestosterone (DHT). AVODART riduce la produzione di DHT nel corpo, portando al restringimento della prostata ingrossata nella maggior parte degli uomini. Sebbene alcuni uomini abbiano meno problemi e sintomi dopo 3 mesi di trattamento con AVODART, di solito è necessario un periodo di trattamento di almeno 6 mesi per vedere se AVODART 0,5 mg funziona per te.
Queste informazioni per il paziente sono state approvate dalla Food and Drug Administration statunitense.
