Lacrime artificiali: Lumigan 3ml Uso, Effetti Collaterali e Dosaggio. Prezzo in farmacia online. Farmaci generici senza ricetta.
Cos'è Lumigan e come si usa?
Lumigan 3ml è un medicinale da prescrizione usato per trattare i sintomi della pressione intraoculare elevata causati da alcuni tipi di glaucoma e ipotricosi delle ciglia. Lumigan può essere usato da solo o con altri farmaci.
Lumigan appartiene a una classe di farmaci chiamati Antiglaucoma, Prostaglandin Agonists.
Non è noto se Lumigan sia sicuro ed efficace nei bambini.
Quali sono i possibili effetti collaterali di Lumigan?
Lumigan può causare gravi effetti collaterali tra cui:
- gonfiore agli occhi,
- arrossamento degli occhi,
- forte disagio agli occhi,
- formazione di croste o drenaggio dall'occhio,
- la vista cambia, e
- palpebre rosse, gonfie o pruriginose
Chiedi immediatamente assistenza medica, se hai uno dei sintomi sopra elencati.
Gli effetti collaterali più comuni di Lumigan includono:
- arrossamento degli occhi
Informi il medico se ha qualche effetto collaterale che ti infastidisce o che non scompare.
Questi non sono tutti i possibili effetti collaterali di Lumigan. Per ulteriori informazioni, chiedi al tuo medico o al farmacista.
Chiamate il vostro medico per un consiglio medico circa gli effetti collaterali. È possibile segnalare gli effetti collaterali alla FDA al numero 1-800-FDA-1088.
DESCRIZIONE
LUMIGAN® (soluzione oftalmica bimatoprost) 0,03% è un analogo sintetico della prostamide con attività ipotensiva oculare. Il suo nome chimico è (Z)-7-[(1R,2R,3R,5S)-3,5-Diidrossi-2[(1E,3S)-3-idrossi-5-fenil-1-pentenil]ciclopentil]- 5-N-etileptenammide e il suo peso molecolare è 415,58. La sua formula molecolare è C25H37NO4. La sua struttura chimica è:
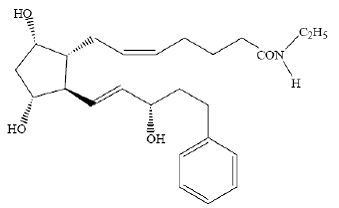
Il bimatoprost è una polvere, molto solubile in alcol etilico e alcol metilico e leggermente solubile in acqua. LUMIGAN® 0,03% è una soluzione oftalmica limpida, isotonica, incolore e sterile con un'osmolalità di circa 290 mOsmol/kg.
LUMIGAN® 0,03% contiene Attivo: bimatoprost 0,3 mg/mL; Inattivi: benzalconio cloruro 0,05 mg/mL; cloruro di sodio; fosfato di sodio, bibasico; acido citrico; e acqua purificata. Si possono aggiungere sodio idrossido e/o acido cloridrico per regolare il pH. Il pH durante la sua durata varia da 6,8-7,8.
INDICAZIONI
LUMIGAN® (soluzione oftalmica bimatoprost) 0,01% è indicato per la riduzione della pressione intraoculare elevata in pazienti con glaucoma ad angolo aperto o ipertensione oculare.
DOSAGGIO E SOMMINISTRAZIONE
La dose raccomandata è di una goccia nell'occhio o negli occhi interessati una volta al giorno la sera. LUMIGAN® (soluzione oftalmica bimatoprost) 0,01% non deve essere somministrato più di una volta al giorno poiché è stato dimostrato che una somministrazione più frequente di analoghi delle prostaglandine può ridurre l'effetto di riduzione della pressione intraoculare.
La riduzione della pressione intraoculare inizia circa 4 ore dopo la prima somministrazione con il massimo effetto raggiunto entro circa 8-12 ore.
LUMIGAN® 0,01% può essere utilizzato in concomitanza con altri farmaci oftalmici topici per abbassare la pressione intraoculare. Se viene utilizzato più di un farmaco oftalmico topico, i farmaci devono essere somministrati a distanza di almeno cinque (5) minuti l'uno dall'altro.
COME FORNITO
Forme di dosaggio e punti di forza
Soluzione oftalmica contenente bimatoprost 0,1 mg/mL.
Conservazione e consegna
LUMIGAN® (soluzione oftalmica bimatoprost) 0,01% è fornito sterile in flaconi dispenser oftalmici in polietilene a bassa densità bianco opaco e puntali con tappi in polistirene turchese nelle seguenti dimensioni:
2,5 ml riempire un contenitore da 5 ml - NDC 0023-3205-03 5 ml riempire un contenitore da 10 ml - NDC 0023-3205-05 7,5 ml riempire un contenitore da 10 ml - NDC 0023-3205-08
Magazzinaggio: Conservare a una temperatura compresa tra 2°C e 25°C (da 36°F a 77°F).
Dopo l'apertura, LUMIGAN® 0,01% può essere utilizzato fino alla data di scadenza indicata sul flacone.
Distribuito da: Allergan USA, Inc. Madison, NJ 07940. Revisionato: marzo 2022
EFFETTI COLLATERALI
Le seguenti reazioni avverse sono descritte altrove nell'etichettatura:
- Pigmentazione compresa la pigmentazione blefarale e l'iperpigmentazione dell'iride [vedi AVVERTENZE E PRECAUZIONI ]
- Cambiamenti alle ciglia [vedi AVVERTENZE E PRECAUZIONI ]
- Infiammazione intraoculare [vedi AVVERTENZE E PRECAUZIONI ]
- Edema maculare [vedi AVVERTENZE E PRECAUZIONI ]
- Ipersensibilità [vedi CONTROINDICAZIONI ]
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
In uno studio clinico di 12 mesi con soluzioni oftalmiche di bimatoprost allo 0,01%, la reazione avversa più comune è stata l'iperemia congiuntivale (31%). Circa l'1,6% dei pazienti ha interrotto la terapia a causa di iperemia congiuntivale. Altre reazioni avverse al farmaco (riportate nell'1-4% dei pazienti) con LUMIGAN® Lo 0,01% in questo studio includeva edema congiuntivale, emorragia congiuntivale, irritazione oculare, dolore oculare, prurito oculare, eritema palpebrale, prurito palpebrale, crescita delle ciglia, ipertricosi, irritazione del sito di instillazione, cheratite puntata, iperpigmentazione cutanea, visione offuscata e acuità visiva ridotto.
Esperienza di post marketing
Le seguenti reazioni avverse sono state identificate durante l'uso successivo all'approvazione di LUMIGAN® 0,01%. Poiché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimarne in modo affidabile la frequenza o stabilire una relazione causale con l'esposizione al farmaco. Queste reazioni, che sono state scelte per l'inclusione a causa della loro gravità, frequenza delle segnalazioni, possibile nesso causale con LUMIGAN® , o una combinazione di questi fattori include: sintomi simil-asma, vertigini, secchezza oculare, dispnea, secrezione oculare, edema oculare, sensazione di corpo estraneo, mal di testa, ipersensibilità inclusi segni e sintomi di allergia oculare e dermatite allergica, ipertensione, aumento della lacrimazione, alterazioni periorbitali e palpebrali compreso l'approfondimento del solco palpebrale e la fotofobia.
INTERAZIONI DI DROGA
Nessuna informazione fornita
AVVERTENZE
Incluso come parte del "PRECAUZIONI" Sezione
PRECAUZIONI
Pigmentazione
È stato segnalato che la soluzione oftalmica di bimatoprost provoca alterazioni dei tessuti pigmentati. I cambiamenti più frequentemente riportati sono stati l'aumento della pigmentazione dell'iride, del tessuto periorbitale (palpebra) e delle ciglia. Si prevede che la pigmentazione aumenti fintanto che viene somministrato il bimatoprost. Il cambiamento della pigmentazione è dovuto all'aumento del contenuto di melanina nei melanociti piuttosto che all'aumento del numero di melanociti. Dopo l'interruzione del bimatoprost, è probabile che la pigmentazione dell'iride sia permanente, mentre in alcuni pazienti è stato riportato che la pigmentazione del tessuto periorbitale e le alterazioni delle ciglia sono reversibili. I pazienti che ricevono il trattamento devono essere informati della possibilità di un aumento della pigmentazione. Gli effetti a lungo termine dell'aumento della pigmentazione non sono noti.
Il cambiamento di colore dell'iride potrebbe non essere evidente per diversi mesi o anni. Tipicamente, la pigmentazione marrone intorno alla pupilla si diffonde concentricamente verso la periferia dell'iride e l'intera iride o parti dell'iride diventano più brunastre. Né i nevi né le lentiggini dell'iride sembrano essere interessati dal trattamento. Sebbene il trattamento con LUMIGAN® (soluzione oftalmica bimatoprost) allo 0,01% possa essere continuato nei pazienti che sviluppano una pigmentazione dell'iride notevolmente aumentata, questi pazienti devono essere esaminati regolarmente.
Cambiamenti alle ciglia
LUMIGAN® 0,01% può modificare gradualmente ciglia e peli vellus nell'occhio trattato. Queste modifiche includono una maggiore lunghezza, spessore e numero di ciglia. I cambiamenti delle ciglia sono generalmente reversibili con l'interruzione del trattamento.
Infiammazione intraoculare
È stato riportato che gli analoghi delle prostaglandine, incluso il bimatoprost, causano infiammazione intraoculare. Inoltre, poiché questi prodotti possono esacerbare l'infiammazione, si deve usare cautela nei pazienti con infiammazione intraoculare attiva (p. es., uveite).
Edema maculare
Durante il trattamento con bimatoprost soluzione oftalmica è stato riportato edema maculare, incluso edema maculare cistoide. LUMIGAN® 0,01% deve essere usato con cautela in pazienti afachici, in pazienti pseudofachici con rottura della capsula del cristallino posteriore o in pazienti con noti fattori di rischio per l'edema maculare.
Cheratite batterica
Sono stati segnalati casi di cheratite batterica associata all'uso di contenitori multidose di prodotti oftalmici topici. Questi contenitori erano stati inavvertitamente contaminati da pazienti che, nella maggior parte dei casi, avevano una concomitante malattia della cornea o un'interruzione della superficie epiteliale oculare.

Uso delle lenti a contatto
LUMIGAN® 0,01% contiene benzalconio cloruro, che può essere assorbito e causare lo scolorimento delle lenti a contatto morbide. Le lenti a contatto devono essere rimosse prima dell'instillazione di LUMIGAN® 0,01% e possono essere reinserite 15 minuti dopo la sua somministrazione.
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Cancerogenesi
Il bimatoprost non è risultato cancerogeno né nei topi né nei ratti quando somministrato per via orale per 104 settimane a dosi fino a 2 mg/kg/giorno e 1 mg/kg/giorno, rispettivamente (192 e 291 volte l'esposizione sistemica umana stimata al bimatoprost 0,03% dosati bilateralmente una volta al giorno, rispettivamente, in base ai livelli di AUC nel sangue)
Mutagenesi
Il bimatoprost non è risultato mutageno o clastogeno nel test di Ames, nel test del linfoma del topo o nel test del micronucleo del topo in vivo.
Compromissione della fertilità
Il bimatoprost non ha alterato la fertilità nei ratti maschi o femmine fino a dosi di 0,6 mg/kg/die (almeno 103 volte l'esposizione umana raccomandata a bimatoprost 0,03% somministrato bilateralmente una volta al giorno in base ai livelli di AUC nel sangue).
Utilizzare in popolazioni specifiche
Gravidanza
Riepilogo dei rischi
Non ci sono studi adeguati e ben controllati sulla somministrazione di LUMIGAN® (soluzione oftalmica bimatoprost) allo 0,01% in donne in gravidanza. Non vi è alcun aumento del rischio di difetti alla nascita gravi o aborti spontanei sulla base dell'esperienza post-marketing di bimatoprost.
Negli studi sullo sviluppo embriofetale, la somministrazione di bimatoprost a topi e ratti gravidi durante l'organogenesi ha provocato aborto e parto precoce a dosi orali almeno 33 volte (topi) o 94 volte (ratti) l'esposizione umana a bimatoprost 0,03% somministrato bilateralmente una volta al giorno ( in base all'area del sangue sotto i livelli della curva [AUC]). Questi effetti avversi non sono stati osservati a 2,6 volte (topi) e 47 volte (ratti) l'esposizione umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno (basato sui livelli di AUC nel sangue).
Negli studi sullo sviluppo pre/postnatale, la somministrazione di bimatoprost a ratti gravidi dall'organogenesi alla fine dell'allattamento ha comportato una riduzione della lunghezza della gestazione e del peso corporeo del feto e un aumento della mortalità fetale e dei cuccioli a dosi orali di almeno 41 volte l'esposizione sistemica umana al bimatoprost 0,03 % somministrato bilateralmente una volta al giorno (basato sui livelli di AUC nel sangue). Non sono stati osservati effetti avversi nella progenie di ratto a esposizioni stimate 14 volte l'esposizione umana a bimatoprost 0,03% somministrato bilateralmente una volta al giorno (basato sui livelli di AUC nel sangue).
Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, LUMIGAN® 0,01% deve essere somministrato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Dati
Dati sugli animali
In uno studio sullo sviluppo embriofetale sui ratti, l'aborto è stato osservato in ratte gravide a cui è stato somministrato bimatoprost per via orale durante l'organogenesi a 0,6 mg/kg/die (94 volte l'esposizione sistemica umana al bimatoprost 0,03% dosato bilateralmente una volta al giorno, sulla base dell'AUC). Il livello senza effetti avversi osservati (NOAEL) per l'aborto è stato di 0,3 mg/kg/die (stimato a 47 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, sulla base dell'AUC). Non sono state osservate anomalie nei feti di ratto a dosi fino a 0,6 mg/kg/die.
In uno studio sullo sviluppo embriofetale sui topi, sono stati osservati aborto e parto precoce in topi gravidi trattati con bimatoprost per via orale durante l'organogenesi a dosi maggiori o uguali a 0,3 mg/kg/giorno (33 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, basato sull'UAC). Il NOAEL per aborto e parto anticipato era di 0,1 mg/kg/die (2,6 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, sulla base dell'AUC). Non sono state osservate anomalie nei feti di topo a dosi fino a 0,6 mg/kg/die (72 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, sulla base dell'AUC).
In uno studio sullo sviluppo pre/postnatale, il trattamento di ratte gravide con bimatoprost per via orale dal giorno 7 di gestazione al giorno 20 di allattamento ha comportato una riduzione della durata della gestazione, un aumento dei riassorbimenti tardivi, morti fetali e mortalità postnatale dei cuccioli e una riduzione del peso corporeo dei piccoli a dosi superiori a o pari a 0,3 mg/kg/giorno. Questi effetti sono stati osservati a esposizioni almeno 41 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, sulla base dell'AUC. Il NOAEL per lo sviluppo postnatale e le prestazioni di accoppiamento della prole è stato di 0,1 mg/kg/giorno (stimato a 14 volte l'esposizione sistemica umana al bimatoprost 0,03% somministrato bilateralmente una volta al giorno, sulla base dell'AUC).
Allattamento
Riepilogo dei rischi
Non è noto se il trattamento oculare topico con LUMIGAN® 0,01% possa determinare un assorbimento sistemico sufficiente a produrre quantità rilevabili nel latte materno. Negli studi sugli animali, è stato dimostrato che il bimatoprost è presente nel latte materno di ratti che allattano a una dose endovenosa (cioè 1 mg/kg) 970 volte la RHOD (su base mg/rn 2), tuttavia non sono disponibili dati sugli animali a dosi clinicamente rilevanti.
I benefici per lo sviluppo e la salute dell'allattamento al seno dovrebbero essere considerati insieme alla necessità clinica della madre di LUMIGAN® 0,01% e qualsiasi potenziale effetto avverso sul bambino allattato al seno da LUMIGAN® 0,01%.
Uso pediatrico
L'uso in pazienti pediatrici di età inferiore ai 16 anni non è raccomandato a causa di potenziali problemi di sicurezza legati all'aumento della pigmentazione in seguito all'uso cronico a lungo termine.
Uso geriatrico
Non sono state osservate differenze cliniche complessive in termini di sicurezza o efficacia tra pazienti anziani e altri pazienti adulti.
OVERDOSE
Non sono disponibili informazioni sul sovradosaggio nell'uomo. In caso di sovradosaggio con LUMIGAN® (soluzione oftalmica bimatoprost) 0,01%, il trattamento deve essere sintomatico.
Negli studi orali (per sonda gastrica) su topi e ratti, dosi fino a 100 mg/kg/die non hanno prodotto alcuna tossicità. Questa dose espressa in mg/m2 è almeno 210 volte superiore alla dose accidentale di un flacone di LUMIGAN® 0,01% per un bambino di 10 kg.
CONTROINDICAZIONI
LUMIGAN® 0,01% è controindicato nei pazienti con ipersensibilità al bimatoprost o ad uno qualsiasi degli eccipienti [vedi REAZIONI AVVERSE ].
FARMACOLOGIA CLINICA
Meccanismo di azione
Il bimatoprost, un analogo della prostaglandina, è un analogo strutturale sintetico della prostaglandina con attività ipotensiva oculare. Imita selettivamente gli effetti delle sostanze presenti in natura, le prostamidi. Si ritiene che il bimatoprost riduca la pressione intraoculare (IOP) negli esseri umani aumentando il deflusso dell'umore acqueo attraverso sia il trabecolato che le vie uveosclerali. IOP elevata presenta un importante fattore di rischio per la perdita di campo glaucomatosa. Maggiore è il livello di IOP, maggiore è la probabilità di danni al nervo ottico e perdita del campo visivo.
Farmacocinetica
Assorbimento
Dopo che una goccia di bimatoprost soluzione oftalmica allo 0,03% è stata somministrata una volta al giorno in entrambi gli occhi di 15 soggetti sani per due settimane, le concentrazioni ematiche hanno raggiunto il picco entro 10 minuti dalla somministrazione ed erano al di sotto del limite inferiore di rilevamento (0,025 ng/mL) nella maggior parte dei soggetti entro 1,5 ore dopo la somministrazione. I valori medi di Cmax e AUC0-24 ore erano simili nei giorni 7 e 14 a circa 0,08 ng/mL e 0,09 ng•ora/mL, rispettivamente, indicando che lo stato stazionario è stato raggiunto durante la prima settimana di somministrazione oculare. Non si è verificato un accumulo sistemico significativo di farmaci nel tempo.
Distribuzione
Il bimatoprost è moderatamente distribuito nei tessuti corporei con un volume di distribuzione allo stato stazionario di 0,67 L/kg. Nel sangue umano, il bimatoprost risiede principalmente nel plasma. Circa il 12% del bimatoprost rimane non legato nel plasma umano.
Eliminazione
Metabolismo
Il bimatoprost è la principale specie circolante nel sangue una volta che raggiunge la circolazione sistemica dopo la somministrazione oculare. Il bimatoprost subisce quindi ossidazione, N-deetilazione e glucuronidazione per formare una diversa varietà di metaboliti.
Escrezione
Dopo una dose endovenosa di bimatoprost radiomarcato (3,12 mcg/kg) a sei soggetti sani, la concentrazione ematica massima del farmaco immodificato è stata di 12,2 ng/mL ed è diminuita rapidamente con un'emivita di eliminazione di circa 45 minuti. La clearance ematica totale del bimatoprost è stata di 1,5 l/ora/kg. Fino al 67% della dose somministrata è stata escreta nelle urine mentre il 25% della dose è stata recuperata nelle feci.
Studi clinici
In uno studio clinico di 12 mesi su pazienti con glaucoma ad angolo aperto o ipertensione oculare con una IOP media al basale di 23,5 mmHg, l'effetto di riduzione della PIO di LUMIGAN® 0,01% una volta al giorno (alla sera) è stato fino a 7,5 mmHg.
INFORMAZIONI PER IL PAZIENTE
Potenziale di pigmentazione
Informare i pazienti del potenziale aumento della pigmentazione marrone dell'iride, che può essere permanente. Informare inoltre i pazienti sulla possibilità di scurimento della pelle delle palpebre, che può essere reversibile dopo l'interruzione di LUMIGAN® (soluzione oftalmica di bimatoprost) 0,01%.
Potenziale per i cambiamenti delle ciglia
Informare i pazienti della possibilità di alterazioni delle ciglia e dei peli vellus nell'occhio trattato durante il trattamento con LUMIGAN® 0,01%. Questi cambiamenti possono comportare una disparità tra gli occhi in termini di lunghezza, spessore, pigmentazione, numero di ciglia o peli vellus e/o direzione della crescita delle ciglia. I cambiamenti delle ciglia sono generalmente reversibili con l'interruzione del trattamento.
Gestione del contenitore
Istruire i pazienti a evitare che la punta del contenitore di erogazione entri in contatto con gli occhi, le strutture circostanti, le dita o qualsiasi altra superficie per evitare la contaminazione della soluzione da parte di batteri comuni noti per causare infezioni oculari. L'uso di soluzioni contaminate può causare gravi danni agli occhi e conseguente perdita della vista.
Quando chiedere consiglio al medico
Informare i pazienti che se sviluppano una condizione oculare intercorrente (p. es., trauma o infezione), si sottopongono a chirurgia oculare o sviluppano reazioni oculari, in particolare congiuntivite e reazioni palpebrali, devono consultare immediatamente il proprio medico in merito all'uso continuato di LUMIGAN® 0,01% .
Uso delle lenti a contatto
Avvisare i pazienti che LUMIGAN® 0,01% contiene benzalconio cloruro, che può essere assorbito dalle lenti a contatto morbide. Le lenti a contatto devono essere rimosse prima dell'instillazione di LUMIGAN® 0,01% e possono essere reinserite 15 minuti dopo la sua somministrazione.
Utilizzare con altri farmaci oftalmici
Informare i pazienti che, se viene utilizzato più di un farmaco oftalmico topico, i farmaci devono essere somministrati almeno cinque (5) minuti tra un'applicazione e l'altra.
